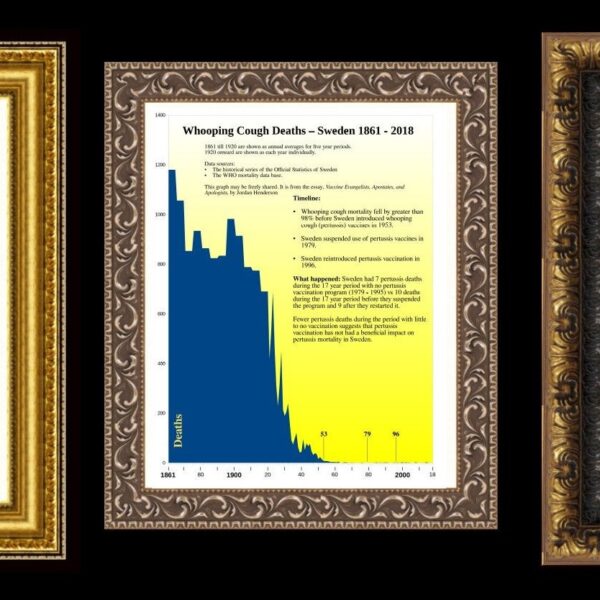
„Většina infekcí, které jsou spojovány s rakovinou u lidí, je v lidské populaci běžná; jsou všudypřítomné. Byly přítomny během celého procesu evoluce člověka.“ (Harald zur Hausen)
Po mnoho desetiletí se vědci snažili připsat rakovinu „virům“. S rakovinou se pokoušeli spojit herpes simplex i HIV, ale nedokázali najít dostatečně přesvědčivé „důkazy“, aby se tyto hypotézy uchytily. V roce 1968 vytvořil Národní institut pro rakovinu (NCI) speciální program pro virové rakoviny, který se pokusil identifikovat lidské „viry“ rakoviny, aby bylo možné proti těmto onemocněním očkovat a předcházet jim. Tento projekt však skončil neúspěchem a v roce 1980 se vědecká komunita shodla na tom, že snahy připsat rakovinu „virům“ jsou marné:
„Navzdory více než desetiletému výzkumu však tato snaha z velké části selhala a koncem 70. let mnoho vědců na tuto myšlenku zanevřelo. Když byl program v roce 1980 ukončen, došlo k lékařskému konsenzu, že viry nejsou významnou příčinou rakoviny u lidí.“
https://www.cancerresearch.org/en-us/blog/august-2014/when-aids-was-a-cancer
Naštěstí pro ty, kteří se této podvodné souvislosti mezi „viry“ a rakovinou drželi, se v roce 1983 objevil německý virolog Harald zur Hausen, aby situaci zachránil. Tento muž se zasloužil o objevení takzvané souvislosti mezi lidským papilomavirem (HPV) a rakovinou děložního čípku. Učinil tak díky svému „objevu“ hybridizovaných klonovaných fragmentů DNA, které jsou údajně HPV, u některých pacientek s rakovinou děložního čípku. Nicméně i po zur Hausenově zjevném objevu této údajné souvislosti byli mnozí k jeho výsledkům velmi skeptičtí, a to z dobrého důvodu.
Nejprve stručně k jeho práci:
„Zur Hausen začal své pátrání hledáním virů v lidských genitálních bradavicích, což vedlo k objevu nového typu papilomaviru, který nazval HPV-6 (verze 1 až 5 již byly objeveny). K jeho velkému zklamání se jeho týmu nepodařilo najít HPV-6 v žádném vzorku rakoviny děložního čípku, ale přivedlo ho to k blízce příbuznému papilomaviru, který nakonec pojmenoval HPV-11. V roce 1983 zur Hausen publikoval důkazy, že HPV-11 byl přítomen ve 3 z 24 vzorků rakoviny děložního čípku, které testoval.
A nyní byl on a jeho tým na koni. Začalo být zřejmé, že existuje mnoho různých typů HPV. Pokračovali v pátrání a objevili HPV-16, který byl zjištěn přibližně v polovině případů rakoviny děložního čípku, dále HPV-18, přítomný přibližně v jednom z pěti vzorků rakoviny děložního čípku.
Začalo být jasné, že infekce těmito dvěma typy úzce souvisí s rakovinou děložního čípku – tento objev nakonec zur Hausenovi vynesl Nobelovu cenu.“

Harald zur Hausen a jeho výtvor na obrázku vytvořeném počítačem.
Bylo jasné, že existuje souvislost mezi HPV a rakovinou děložního čípku? Nula případů rakoviny děložního čípku u HPV-6? 3 z 24 případů u HPV-11? Asi 50 % u HPV-16? 1 z 5 případů u HPV-18? Díky těmto statistikám „bylo jasné“, že existuje souvislost mezi HPV a rakovinou? Správné by bylo uvést, že bylo jasné, že detekovali náhodnou DNA, o níž se předpokládá, že patří nově „objeveným“ HPV, ale rozhodně nebyl prokázán žádný „virus“. Trochu více jasno nám dává zápis o zur Hausenově Nobelově ceně:
Nobelova cena za objev souvislosti mezi HPV a rakovinou děložního čípku již má dopad na medicínu
„Tyto inovace by však nebyly možné bez vytrvalosti jednoho muže, vědce, který navrhl a poté pokračoval v dokazování souvislosti mezi rakovinou děložního čípku a HPV. Tento objev vyvolal v té době – na počátku 80. let 20. století – značný rozruch, protože většina odborníků nevěřila, že by viry mohly způsobovat rakovinu, a těch pár, kteří tomu věřili, se zaměřovalo na jiný virus.
Proti dobovému dogmatuTímto vědcem byl dr. Harald zur Hausen, emeritní profesor a bývalý vědecký ředitel Německého centra pro výzkum rakoviny v Heidelbergu, v němž v současnosti působí. Tento objev mu právě vynesl polovinu Nobelovy ceny za fyziologii a medicínu za rok 2008, o kterou se podělil se dvěma francouzskými vědci, kteří objevili virus lidské imunodeficience (HIV). Je to poslední a nejprestižnější z několika cen, které za tento výzkum již získal, včetně ceny Americké asociace pro výzkum rakoviny za celoživotní dílo.
V prohlášení k Nobelově ceně se uvádí, že dr. zur Hausen šel ‚proti současnému dogmatu doby‘ a jeho návrh na roli HPV při vzniku rakoviny děložního čípku byl v rozporu s převládajícími názory v 70. letech 20. století.‚Můj návrh nebyl v té době příliš vítán,‘ vzpomínal dr. zur Hausen v rozhovoru, který byl po vyhlášení ceny zaznamenán na stránkách nobelprize.org. V té době se pozornost mnoha vědců soustředila na virus herpes simplex; ve skutečnosti v jednom ze svých prvních příspěvků navrhl HPV jako příčinu rakoviny děložního čípku na setkání na Floridě, které bylo speciálně naplánováno k diskusi o výzkumu herpes simplex. ‚Na té schůzce byl můj názor ojedinělý,‘ řekl.
Nějakou dobu trvalo, než se na podporu tohoto návrhu podařilo shromáždit důkazy. Podle prohlášení k Nobelově ceně dr. zur Hausen předpokládal, že pokud nádorové buňky obsahují onkogenní virus, měly by ve svém genomu obsahovat integrovanou virovou DNA. Trvalo však více než 10 let, než se to podařilo prokázat, protože proces byl komplikován tím, že do genomu hostitele byly integrovány pouze části virové DNA.
Průlom nastal na počátku 80. let, kdy dr. zur Hausen a jeho tým nalezli v biopsiích karcinomu děložního čípku novou DNA HPV, a v roce 1983 tak objevili nádorový virus typu HPV 16. V roce 1983 se podařilo objevit nový typ DNA HPV, který se v genomu děložního čípku vyskytoval. O rok později tým naklonoval HPV 16 a HPV 18 od pacientek s rakovinou děložního čípku. V prohlášení k Nobelově ceně se uvádí, že tým dal tyto klony k dispozici vědecké komunitě a dr. zur Hausen poznamenal, že byly ‚velmi volně distribuovány do celého světa‘. Ironií osudu je, že později si tento výzkum nechali patentovat jiní a profitovali z něj.Podle Nobelova výboru jsou od té doby HPV 16 a HPV 18 trvale nalézány přibližně v 70 % biopsií rakoviny děložního čípku na celém světě. Tento výzkum nakonec vedl k vývoji vakcíny proti HPV 16 a HPV 18, která poskytuje více než 95% ochranu před těmito infekcemi. Výbor byl však ve svých předpovědích ohledně dopadu této vakcíny opatrný a poznamenal, že ‚může snížit potřebu chirurgických zákroků a globální zátěž rakovinou děložního čípku‘.
Revoluční myšlenka potřebovala čas, než byla přijataZjištění, že HPV způsobuje rakovinu děložního čípku, bylo ‚naprosto revoluční‘, uvedl dr. Maurie Markman, profesor gynekologické lékařské onkologie v MD Anderson Cancer Center na University of Texas v Houstonu, který působí jako redakční poradce časopisu Medscape Oncology.
‚Bylo to poprvé, kdy se podařilo jednoznačně definovat infekční agens jako příčinu rakoviny, ukázat proces, kterým virová DNA ovlivňuje vznik rakoviny, a nakonec i to, jak by vakcína mohla potenciálně zabránit vzniku rakoviny,‘ uvedl dr. Markman.
Podle dr. Attily Lorincze, profesora molekulární epidemiologie na Wolfsonově institutu preventivní medicíny ve Velké Británii, byla tato myšlenka natolik revoluční, že trvalo poměrně dlouho, než byl tento objev mezi vědeckou komunitou přijat. Mnozí odborníci nemohli uvěřit tomu, že by virus mohl způsobit rakovinu, a místo toho se zaměřovali na jiné faktory prostředí a genetické predispozice. Trvalo dalších deset let, než byla většina skeptiků umlčena, a ještě před několika lety se našlo několik vzdorujících starších lékařů a vědců.“

Zur Hausen PŘEDPOKLÁDAL, že pokud by šlo o „onkogenní viry“, pak by se „virová“ DNA integrovala do genomů nádorů. Jinými slovy, není třeba hledat „virus“, stačí pouze fragmenty DNA s ním spojené. Detekce „virové“ RNA/DNA je však v podstatě bezvýznamná, jak nedávno ukázala prohlášení o odmítnutí odpovědnosti u PCR testů na „SARS-CoV-2“, jako je tento:
„Detekce virové RNA nemusí znamenat přítomnost infekčního viru nebo to, že 2019-nCoV je původcem klinických příznaků.“
https://www.google.com/url?sa=t&source=web&rct=j&url=https://www.fda.gov/media/134922/download&ved=2ahUKEwjniIzR5In3AhWELc0KHdreAPUQFnoECCoQAQ&usg=AOvVaw26_v3GqAn8Y9-F3w81SSQR
Zur Hausen nalezl novou DNA, nikoli nový „virus“. I k tomuto objevu byli jeho kolegové a dokonce i komentář k udělení Nobelovy ceny skeptičtí. Možná chtěli vidět skutečný purifikovaný/izolovaný HPV odebraný přímo od nemocného pacienta místo náhodně hybridizovaných fragmentů DNA považovaných za nový „virus“? Možná potřebovali vidět důkaz, že tento „virus“ je skutečně patogenní? Nalezení náhodných kousků DNA u některých pacientek s rakovinou děložního čípku a tvrzení, že se jedná o novou verzi HPV a příčinu zmíněné rakoviny, vyžaduje řádné důkazy. Toto nebyl důkaz.
Aby bylo možné se vůbec pokusit tvrdit, že DNA, kterou zur Hausen detekoval, byla „virová“, muselo by se prokázat, že něco takového jako lidský „papilomavirus“ existuje, a teprve pak by bylo možné jej rozdělit na stovky jeho různých verzí a prohlásit je za příčinu rakoviny děložního čípku. To samozřejmě vyvolává otázku: Byl někdy HPV řádně purifikován a izolován přímo z nemocného pacienta a poté prokázán jako patogenní přirozeným způsobem?
Hledání odpovědi na tuto otázku mě přivedlo k práci Maurice Strausse, Henryho Buntinga a Josepha Melnicka z roku 1949. Tito vědci odebrali bradavice z rukou a nohou dětí, rozemleli je, vzniklou tkáň smíchali s oxidem hlinitým a vodou, směs nějakou dobu velmi rychle odstřeďovali a pak odebrali supernatant a pokovili ho chromem, aby si mohli vzorek prohlédnout pod elektronovým mikroskopem. Vědci pak předpokládali, že všechny pozorované částice, které připomínaly „virus“, jím skutečně byly. V tomto případě tři výzkumníci porovnali své vybrané částice s částicemi, které se nacházely v rostlinách, a tvrdili, že objevili „virus“, protože částice se podobaly rostlinným „virům“. Dokázali Strauss, Bunting a Melnick skutečně, že tyto částice, o nichž se domnívali, že jsou HPV, byly skutečným „virem“? Ne, protože ve své práci se vůbec nepokusili prokázat patogenitu. Jediné, co tito tři výzkumníci udělali, bylo, že ukázali na náhodné částice a prohlásili, že jde o „virus“, a proto se v názvu a shrnutí jejich práce objevilo označení „částice podobné virům“. Níže jsou uvedeny hlavní body:
„Krystalické“ částice podobné virům z kožních papilomů charakterizované intranukleárními inkluzními tělísky
„Toto je zpráva o pozorování tělísek podobných virům, která byla získána z kožních papilomů, pomocí elektronového mikroskopu. Tyto papilomy se vyznačují přítomností intranukleárních inkluzních tělísek a elementární tělíska z nich získaná mají tendenci být uspořádána do krystalického vzoru. Pět takových lézí bylo studováno elektronovou mikroskopií.“
„Příprava materiálu byla ve všech případech stejná. Polovina každé léze byla fixována ve formalínu pro tkáňové řezy, zatímco zbytek byl okamžitě rozmělněn s oxidem hlinitým a destilovanou vodou a vyčištěn pomocí centrifugace tekutiny supernatantu při 2 000 otáčkách za minutu po dobu 5 minut, po níž následovala centrifugace vzniklé tekutiny supernatantu při 6 000 otáčkách za minutu po dobu 15 až 45 minut. Malé kapky tekutiny supernatantu získané při 6 000 otáčkách za minutu a resuspendovaný sediment byly umístěny na kolodiové podložky pro elektronovou mikroskopii. Ty byly stínovány chromem pod úhlem 1:7.“
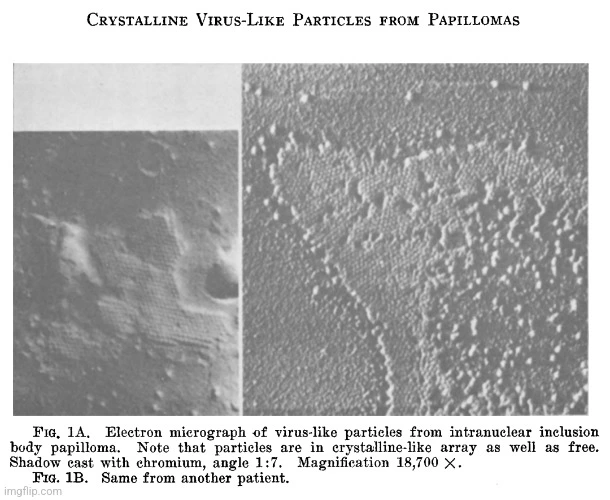
„Vyšetření elektronovým mikroskopem (RCA typ EMU) odhalilo sférické částice nejhojněji zastoupené v sedimentu suspenze získaném z papilomů při 6000 otáčkách za minutu, které vykazovaly intranukleární inkluzní tělíska. Tyto částice byly často uspořádány do krystalických shluků nebo vrstev s průměrnou hodnotou průměru 52 mμ a rozsahem 50 až 53 mμ (obr. 1). Takové uspořádání se podobá uspořádání, které bylo dříve zaznamenáno u krystalických rostlinných virů (Price, Williams, Wyckoff). Když tyto částice nebyly v krystalickém uspořádání, měly průměrnou hodnotu průměru 68 mμ s rozsahem 56 až 80 mμ.“
„Pátrání v nashromážděném materiálu laboratoře chirurgické patologie nemocnice v New Havenu odhalilo 31 dalších kožních lézí histologicky podobných výše popsaným papilomům s inkluzními tělísky. Věk těchto pacientů se pohyboval od 2 do 68 let. Dále bylo nalezeno 158 typických bradavic od jedinců ve věku 5 až 80 let.“
„Shrnutí: Při studiu suspenzí 5 kožních papilomů byly elektronovou mikroskopií pozorovány částice podobné virům, které mají tendenci být uspořádány do krystalického vzoru. Histologické vyšetření stejných tkání odhalilo intranukleární inkluzní tělíska a charakteristickou cytoplazmatickou hmotu v buňkách hyperplastické epidermis. Při prozkoumání chirurgického patologického materiálu bylo vyšetřeno 31 lézí podobného histologického vzhledu spolu se 158 typickými bradavicemi.“
Různé barvy = různé „viry“
V roce 1952 byli Melnick, Bunting a Strauss zpět s další studií. Po přečtení je zřejmé, že ani tři roky po svých prvních zjištěních nemohli tito tři výzkumníci tvrdit, že HPV je „virus“: Opět hovoří o HPV jako o částicích „podobných virům“. Při zkoumání pod elektronovým mikroskopem opět odkazovali na kresby a kodachromy, aby nedošlo k záměně hmoty s chromatinem (látka uvnitř chromozomu složená z bílkovin, RNA a DNA). Uvádějí, že krystalická struktura byla „pravděpodobně“ „virem“ především kvůli podobnému vzoru, který tvořila s rostlinnými „viry“. Připouštějí, že materiál, který zkoumali, byl nečistý, že histopatologické změny byly ZŘEJMĚ spojeny s částicemi „podobnými virům“ a že eozinofilní inkluzní tělísko PRAVDĚPODOBNĚ svědčilo o přítomnosti „viru“. Tedy opět žádný důkaz, že HPV je „virus“:
ELEKTRONOVÁ MIKROSKOPIE VIRŮ LIDSKÉHO PAPILOMU, MOLLUSCUM CONTAGIOSUM A VAKCÍNIE, VČETNĚ POZOROVÁNÍ TVORBY VIRU UVNITŘ BUŇKY
„Tato diskuse se bude zabývat elektronmikroskopickými studiemi dvou lézí lidské kůže, papilomu a molluscum contagiosum. Obě onemocnění jsou infekční, etiologická agens jsou filtrovatelná. Práce na těchto virech je však omezena tím, že jediným známým hostitelem je člověk. Naše práce na lidském papilomu byla provedena konvenčním způsobem, tj. izolací buněčných složek diferenciální centrifugací a jejich zkoumáním v elektronovém mikroskopu.“
„Materiál z papilomů a z kontrolních vzorků se rozmělní s oxidem hlinitým a destilovanou vodou, odstředí se při 2000 otáčkách za minutu po dobu 5 minut a vzniklá tekutina supernatantu se podrobí dalšímu odstřeďování při 6000 otáčkách za minutu po dobu 45 minut. Sediment se resuspenduje v malém objemu destilované vody (asi 1 ml). Malá kapka se umístí na kolodiové stínítko elektronového mikroskopu a před zkoumáním se zastíní chromem nebo palladiem. Přestože izolované částice lze nalézt ve všech vzorcích, částice jsou uspořádány do krystalických shluků s takovou pravidelností, že se toto uspořádání jeví jako charakteristické.“
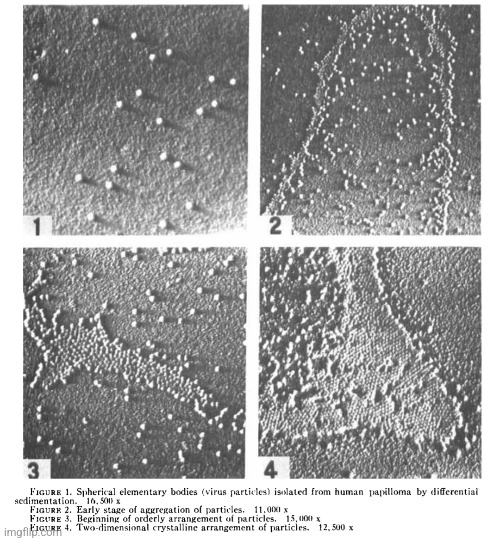
„Histologický vzhled papilomů produkujících částice podobné virům je podrobně popsán v práci Buntinga a Strausse.“
„Absolutní identifikace intranukleárních inkluzních tělísek ve Feulgenových preparátech, aby nedošlo k záměně s hmotou chromatinu, byla zajištěna porovnáním s kresbami a kodachromy stejných buněk při předchozím barvení hematoxylinem a eosinem. Mikrofotografie byly pořízeny při vlnových délkách 2650 a 2800 Å a hodnoceny vizuálně.“
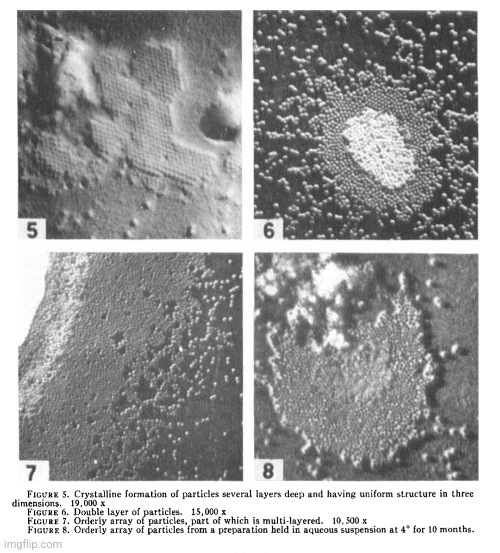
„Útvary izolované z těchto papilomů představují první krystalickou látku tohoto typu získanou z jakékoli živočišné tkáně. Tato charakteristická částice je pravděpodobně virové povahy a je odpovědná za vznik a růst bradavic. V minulosti bylo zjištěno, že takové krystalické útvary vytvářejí sférické viry. To platí zejména pro některé rostlinné viry a příležitostně vysoce purifikované preparáty sférických bakteriofágů poskytovaly podobné obrazce. Skutečnost, že relativně nečisté preparáty suspenzí těchto bradavic dávají takové obrazce, však ukazuje na výrazný stupeň vzájemného vztahu těchto částic a jejich uniformitu. Průměr těchto částic, 52 mμ, je řádově stejný jako průměr zjištěný u viru Shopeho králičího papilomu.“
„Charakteristické histopatologické změny pozorované u těchto lézí, které se nevyskytují u všech běžných bradavic, jsou zřejmě spojeny s přítomností výše popsaných částic podobných virům. Dalo by se usuzovat, že normální vývoj epidermálních buněk byl narušen ve větší míře, než k jaké dochází u prosté hyperplazie. Eozinofilní intranukleární inkluzní tělísko, které pravděpodobně svědčí o přítomnosti viru, je malé, když je poprvé pozorovatelné v první nebo druhé vrstvě buněk nad bazální vrstvou. Jeho velikost se zdvojnásobí, když se jeho identita ztratí v pyknotických jádrech parakeratotické stratum corneum.“
Jediný způsob, jak mohou nalézt částice HPV, je na obrázcích vytvořených počítačem.
Z nejdůležitějších informací převzatých z výše uvedených dvou prací lze s jistotou říci, že HPV nebyl nikdy řádně purifikován/izolován ani u něj nebyla prokázána patogenita. Vědci vybrali částice z nečistých vzorků, o nichž se domnívali, že jsou „virem“, na základě obrázků rostlinných „virů“. Nyní, když už máme neexistenci purifikovaného/izolovaného „viru“ HPV vyřešenou, můžeme se posunout o několik desetiletí dopředu, do roku 1983, abychom zjistili, jaké důkazy Harald zur Hausen vykouzlil, aby mohl tvrdit, že nikdy nepurifikované/neizolované částice, o nichž se předpokládalo, že jsou HPV, způsobují rakovinu děložního čípku.
Po přečtení této studie zjistíte, že v ní nebyly nikdy nalezeny ani použity žádné částice považované za „virus“. Jediné, co se v ní tvrdí, je detekce „nové“ DNA z jednoho vzorku rakoviny děložního čípku, o níž se pak předpokládalo, že je novým HPV, a to na základě toho, zda DNA hybridizovala s jinými sekvencemi HPV. Zur Hausen tuto DNA naklonoval do fága a poté tento syntetický výtvor použil ke zkoumání dalších vzorků rakoviny a zjistil smíšené výsledky. DNA HPV byla pozorována v benigních nenádorových vzorcích a nekonzistentně se vyskytovala u příbuzných nádorových onemocnění. Zjistil také geografický rozdíl mezi vzorky testovanými v Německu, kde byla DNA nalezena u 61 % vzorků, a vzorky z Keni a Brazílie, kde byla nalezena u 34 % vzorků. Zajímavé je, že zur Hausen přiznal, že charakterizace typů „papilomavirů“ byla založena výhradně na analýze DNA po molekulárním klonování a že mnoho klasifikovaných typů bylo identifikováno pouze z nádorové DNA nesoucí tyto genomy. Rovněž přiznal, že DNA dosud nebyla prokázána v částicích „papilomavirů“, čímž potvrdil, že kmeny HPV existují pouze jako sekvence DNA, a nikoli jako fyzické částice. Jako poslední hřebíček do rakve svých vlastních zjištění zur Hausen dospěl k závěru, že pravidelná přítomnost DNA HPV ve vzorcích biopsií genitálního karcinomu nedokazuje etiologické zapojení těchto „virových“ infekcí. Celý smyšlený důkaz pro tvrzení, že HPV způsobuje rakovinu děložního čípku, si můžete přečíst zde:
DNA papilomaviru z karcinomu děložního čípku a jeho výskyt ve vzorcích biopsie rakoviny z různých geografických oblastí
„ABSTRAKT
DNA z jednoho vzorku biopsie invazivního karcinomu děložního čípku obsahovala sekvence hybridizující s DNA lidského papilomaviru (HPV) typu 11 pouze za málo přísných podmínek. Tato DNA byla molekulárně klonována ve fágu λ. Za přísných podmínek hybridizace zkříženě hybridizovala v malé míře (méně než 0,1 %) s HPV typy 10, 14 a 15 a nevykazovala žádnou homologii s DNA jiných lidských typů HPV. Navrhujeme ji proto předběžně označit jako HPV 16. DNA HPV 16 byla použita jako sonda k testování dalších vzorků nádorových biopsií z karcinomu děložního čípku, vulvy a penisu, jakož i benigních genitálních bradavic (condylomata acuminata) a dysplazií děložního čípku na přítomnost homologních sekvencí. U 61,1 % (11/18) vzorků karcinomu děložního čípku od německých pacientek byly za vysoce přísných podmínek nalezeny sekvence hybridizující s DNA HPV 16. Naproti tomu tuto DNA odhalilo pouze 34,8 % (8/23) bioptických vzorků karcinomů z Keni a Brazílie. Vzorky biopsie karcinomu vulvy a penisu hybridizovaly na 28,6 % (2/7), resp. 25 % (1/4). Pouze 2 z 33 vzorků condylomata acuminata obsahovaly DNA HPV 16. Oba pozitivní nádory navíc obsahovaly DNA HPV 6 nebo HPV 11. Údaje tedy naznačují, že v maligních nádorech převažuje DNA HPV 16, což činí náhodnou kontaminaci papilomavirovou DNA ze sousedních papilomů spíše nepravděpodobnou. Vzácná přítomnost u benigních genitálních papilomů spolu s běžnými genitálními papilomaviry naznačuje závislost replikace HPV 16 na pomocném viru.
Přibývá důkazů, že papilomaviry se mohou podílet na etiologii některých druhů rakoviny u zvířat a lidí. To odpovídá karcinomům vyvolaným Shopeho papilomavirem u králíků, fibrosarkomům a karcinomům jícnu vyvolaným bovinními papilomaviry, očním karcinomům u skotu a kožním karcinomům u ovcí a maligní konverzi pozorované u epidermodysplasia verruciformis, stejně jako příležitostně u papilomatózy hrtanu. Společným rysem maligní konverze po infekci papilomaviry je, že zřejmě vyžaduje další interakci s iniciačními událostmi.Rakovina lidských pohlavních orgánů odhaluje epidemiologické charakteristiky infekčních událostí. Bylo zjištěno, že roli hrají dvě skupiny virů: viry herpes simplex a lidské papilomaviry (HPV). Vzhledem k tomu, že naše skupina konzistentně nebyla schopna detekovat DNA herpes simplex ve vzorcích biopsií karcinomu děložního čípku, ale poskytla důkazy o iniciační funkci těchto virových infekcí, zaměřili jsme svoji pozornost na perzistenci DNA papilomaviru v genitálních nádorech.
U genitálních papilomů (condylomata acuminata a atypická kondylomata děložního čípku) byly pravidelně prokazovány dva typy genitálních papilomavirových infekcí: HPV 6 a HPV 11. V rámci benigních genitálních nádorů mohou existovat další typy.
Nedávno tři skupiny vědců uvedly přítomnost DNA HPV v některých genitálních nádorech: Green a kol. uvedli, že 2 z 31 karcinomů děložního čípku a 2 z 10 karcinomů vulvy obsahovaly sekvence související s virem, který pravděpodobně představuje HPV 10. Zachow a kol. zaznamenali hybridizaci DNA s DNA HPV 6 za striktních podmínek u dvou verukózních karcinomů vulvy a jednoho karcinomu vulvy in situ. Za málo přísných podmínek DNA z jednoho dalšího verukózního karcinomu a tří karcinomů vulvy in situ hybridizovala s DNA, kterou ve své studii použili Green a kol. Gissmann a kol. detekovali DNA zkříženě reagující s DNA HPV 6 nebo HPV 11 nebo DNA s ní identickou v 6 nádorech Buschke-Lowenstein (nemetastazující verukózní karcinomy) a v 5 z 27 bioptických vzorků karcinomu děložního čípku (3 z nich představovaly invazivní karcinom a 2 karcinomy in situ). V této studii byla DNA hybridizující s HPV 11 za málo přísných podmínek v jednom z těchto nádorů molekulárně klonována a použita jako sonda pro testování benigních a maligních genitálních nádorů na přítomnost homologních sekvencí. Získané údaje odhalují překvapivou prevalenci této DNA v maligních nádorech a její velmi sporadickou přítomnost v benigních papilomech.
MATERIÁLY A METODYBlotová hybridizace buněčné DNA. Vzorky tkáňové biopsie byly uchovávány zmrazené při -20 °C. DNA byla připravena extrakcí pomocí fenolu/chloroformu/isoamylalkoholu podle popisu. Asi 10 µg nádorové DNA bylo rozštěpeno pomocí různých restrikčních endonukleáz, separováno na agarózových gelech a přeneseno na nitrocelulózové filtry.
Hybridizace byla provedena v 0,75 M NaCl/0,075 M citrátu sodném a různých koncentracích formamidu při 42 °C s tRNA místo DNA telecího thymu jako nosičem. DNA HPV značená 32P klonovaná v plazmidu pBR322 byla před nick-translací purifikována z vektoru elektroforézou. Filtry byly promyty v 0,30 M NaCl/0,03 M citrátu sodném/0,1% dodecylsulfátu sodném při příslušné hybridizační teplotě. Pro screening nádorové DNA byly filtry hybridizovány za málo přísných podmínek (40 °C pod teplotou tání, tm), před expozicí a během ní byly udržovány vlhké, znovu promyty za přísných podmínek (20 °C pod tm) a znovu exponovány.
Klonování virové DNA. DNA HPV z karcinomu děložního čípku (laboratorní kód WV 2916) byla klonována v bakteriofágu λ L 47 v jediném místě BamHI a subklonována v pBR322.“
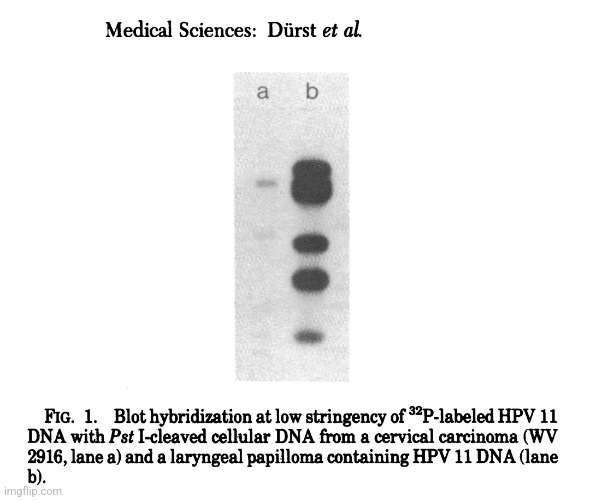
„VÝSLEDKY
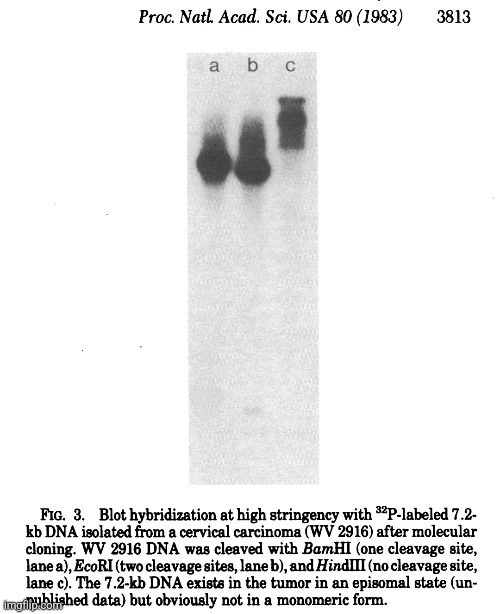
Při screeningu velkého počtu karcinomů děložního čípku za málo přísných podmínek hybridizace (nepublikované údaje) s DNA HPV 11 bylo zjištěno, že jeden nádor (WV 2916) obsahuje papilomavirové sekvence s neobvyklým štěpným vzorem Pst I (obr. 1), které nebyly detekovatelné za přísných podmínek. Další analýza DNA WV 2916 (obr. 2) ukázala hlavní pás 7,2 kb párů po štěpení BamHI. Tento fragment byl zkrácen štěpením pomocí EcoRI a po štěpení HindIII migroval s většinou buněčné DNA (viz také obr. 3).“
„V každém případě byly pozorovány další různě dlouhé pásy v nižších koncentracích (obr. 2 vlevo, dráhy b-d). Promývání za vysoce přísných podmínek (obr. 2 vpravo) odstranilo prakticky všechny signály v DNA WV 2916 ve srovnání s pozitivními kontrolami (obr. 2, pruhy a, e a f). Konstrukce genomové knihovny a následný screening plaků s DNA HPV 11 značenou 32P za málo přísných podmínek vedly k získání řady rekombinantních fágů obsahujících fragment 7,2 kb. Kromě toho několik pozitivních hybridizačních plaků obsahovalo inzert DNA různé délky odpovídající dalším fragmentům viditelným na obr. 2. Charakterizace této DNA bude uvedena na jiném místě.“
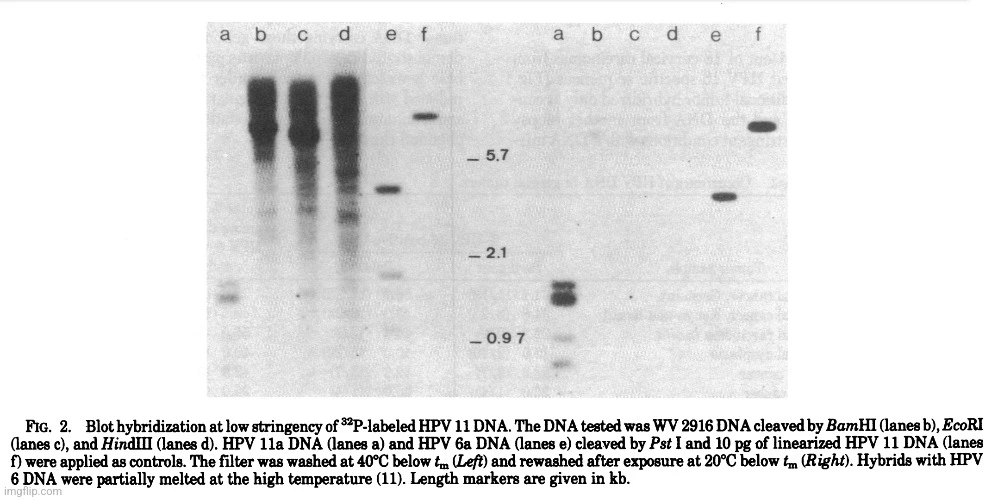
„Fragment o velikosti 7,2 kb byl subklonován v pBR322 a charakterizován pomocí různých restrikčních enzymů (nepublikované údaje). Hybridizace DNA WV 2916 se značenou 7,2 kb DNA za přísných podmínek (obr. 3) vedla k podobnému vzoru, jaký je vidět na obr. 2. Další fragmenty však nebyly touto sondou detekovány, což svědčí o heterogenitě sekvencí HPV u tohoto karcinomu děložního čípku.
Blotová hybridizace 7,2 kb fragmentu s DNA dosud charakterizovaných typů lidských papilomavirů za přísných podmínek vedla k pozitivní reakci pouze u HPV 10, 14 a 15 (G. Orth, osobní sdělení) a jednoho dosud neklasifikovaného izolátu od pacientky s epidermodysplasia verruciformis (G. Orth, osobní sdělení). Rozsah křížové hybridizace s těmito typy byl odhadnut na méně než 0,1 %. Byl proto učiněn závěr, že 7,2 kb fragment z DNA WV 2916 představuje další typ papilomaviru, předběžně označený jako HPV 16.“
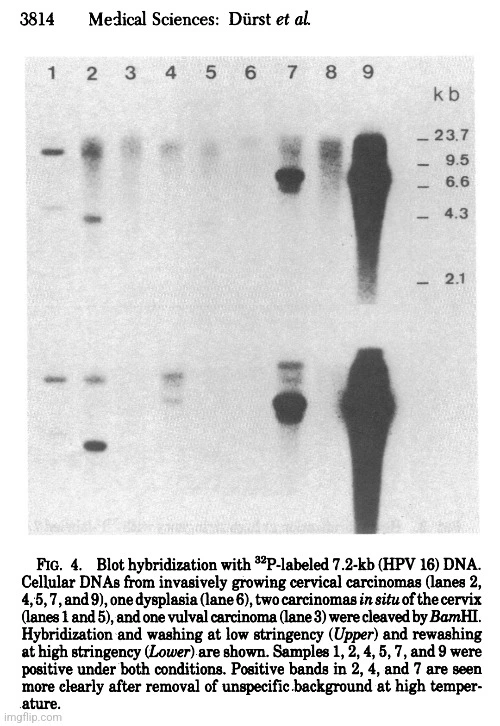
„DNA HPV 16 purifikovaná z vektoru byla použita jako sonda pro screening řady genitálních bradavic, dysplazií a karcinomů in situ, jakož i invazivně rostoucích genitálních karcinomů. Hybridizace za málo přísných podmínek a následné promytí za vysoce přísných podmínek po první expozici umožnila detekci sekvencí specifických pro HPV 16, stejně jako sekvencí papilomaviru vzdáleněji příbuzných ve stejném experimentu (obr. 4 a 5).“
„Jak ukazuje tabulka 1, jedenáct z 18 karcinomů děložního čípku od německých pacientek obsahovalo sekvence specifické pro HPV 16 (obr. 4). DNA z jednoho dalšího nádoru hybridizovala pouze za málo přísných podmínek a DNA z dalšího bioptického vzorku hybridizovala za přísných podmínek se směsí DNA virů HPV 8, 9, 10 a 11. DNA pouze z 8 z 23 bioptických vzorků získaných z Afriky a Jižní Ameriky reagovala za přísných podmínek s DNA HPV 16. Vyšší procento negativních nádorů, které nepocházely z Evropy (65,2 %), a materiálů obsahujících detekovatelné koncentrace různých papilomavirů (8,7 %) naznačuje, že v nádorech pacientů z těchto oblastí mohou převažovat jiné typy virů.
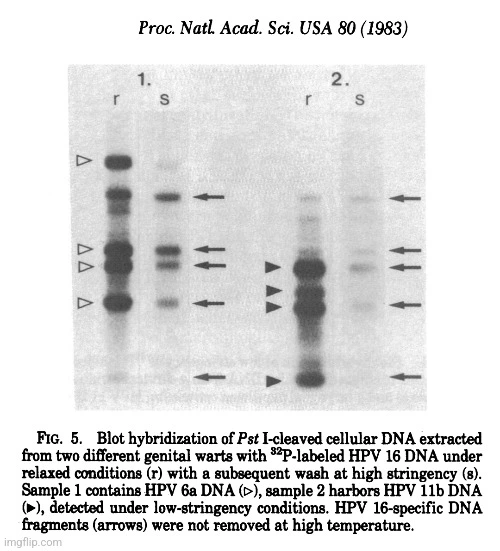
Sekvence specifické pro HPV a příbuzné sekvence byly nalezeny také v některých dysplaziích a karcinomech děložního čípku in situ a také ve dvou karcinomech vulvy a jednom karcinomu penisu (viz tabulka 1). Pouze 2 z 33 (6,1 %) genitálních bradavic však obsahovaly DNA HPV 16, jak bylo stanoveno podle charakteristického vzoru štěpení Pst I (obr. 5). Zajímavé je, že tyto dva nádory rovněž obsahovaly DNA HPV 6 nebo HPV 11.
DISKUSE
Charakterizace typů papilomavirů je v současné době založena výhradně na analýze DNA po molekulárním klonování. Mnohé z klasifikovaných typů byly identifikovány pouze z nádorové DNA nesoucí tyto genomy a dosud nebyly prokázány v částicích papilomaviru. Dosud získané izoláty charakterizuje nízký stupeň homologie bází, zjistitelný za málo přísných podmínek hybridizace, podobná organizace genů a neintegrovaný epizomální stav.“

„Podobné vlastnosti vykazuje i DNA papilomaviru izolovaná přímo z bioptického vzorku lidského invazivního karcinomu děložního čípku. Tato DNA hybridizuje s HPV 6 nebo HPV 11 za málo přísných podmínek a ve velmi nízké míře (méně než 0,1 %) hybridizovala s HPV 10, 14 a 15 a dosud neklasifikovaným typem izolovaným od pacienta s epidermodysplasia verruciformis (G. Orth, osobní sdělení) za vysoce přísných podmínek, zatímco s ostatními typy virů nebyla za těchto podmínek získána žádná pozitivní reakce. Srovnání s DNA HPV 7 nebylo možné, protože klonovaná DNA tohoto typu zatím není k dispozici. Skutečnost, že se dosud DNA tohoto papilomaviru vyskytovala výhradně v bradavicích na rukou řezníka, činí identitu s DNA papilomaviru děložního čípku spíše nepravděpodobnou. Zde popsaný izolát je proto předběžně označen jako HPV 16. DNA HPV 16 se v nádoru vyskytuje v extrachromozomálním stavu (nepublikované údaje). Zdá se však, že cirkulární molekuly jsou přítomny v multimerních formách.
Přítomnost této DNA ve více než 60 % bioptických vzorků karcinomu děložního čípku od německých pacientek a její nepřítomnost ve většině benigních papilomů ze stejné oblasti je překvapivým zjištěním. Odhaluje pozoruhodnou specifičnost infekce HPV 16 pro maligní tkáň. To činí náhodnou kontaminaci ze sousední tkáně papilomu spíše nepravděpodobnou. Přítomnost této DNA ve 2 z 33 případů condylomata acuminata vedle mnohem většího množství HPV 6 nebo HPV 11 by mohla poskytnout vodítko pro zvláštní distribuci DNA HPV 16. Ačkoli HPV 16 existuje v těchto lézích výhradně jako cirkulární molekuly monomerní délky (nepublikované údaje), lze spekulovat o tom, že DNA HPV 16 je defektní a pro enkapsidaci částic a infekčnost vyžaduje komplementaci dalšími typy papilomavirů. To je samozřejmě třeba doložit dalšími experimenty.DNA vykazovala v nádorové tkáni určitou heterogenitu, což naznačuje buď existenci různých podtypů, nebo změnu uspořádání genomu během vývoje rakoviny.
Zdá se, že ve výskytu infekce HPV 16 u rakoviny lidských pohlavních orgánů existují určité geografické rozdíly. Pouze 34,8 % bioptických vzorků karcinomu děložního čípku získaných z Keni a Brazílie obsahovalo zkříženě hybridizující sekvence. To může odrážet prevalenci jiných typů papilomavirů v těchto regionech. Ve vzorcích biopsie rakoviny lidských pohlavních orgánů byly totiž prokázány nejméně tři další typy: HPV 6 u Buschkeho-Lowensteinových nádorů nebo verukózních karcinomů vulvy a penisu, DNA viru pravděpodobně identického s HPV 10 u 2 z 31 karcinomů děložního čípku a u 2 z 10 karcinomů vulvy a DNA HPV 11 u několika karcinomů děložního čípku. Je tedy zřejmé, že v genitálních karcinomech dlaždicových buněk lze nalézt různé typy papilomavirů. To dále podtrhuje tato studie, která odhalila další pozitivní nádory hybridizací za málo přísných podmínek s jinými typy DNA HPV. V současné době činí celkové procento pozitivních bioptických vzorků karcinomu děložního čípku (německé případy) 72 %. Očekáváme však, že charakterizace dalších typů HPV zvýší procento pozitivních nádorů.
Pravidelná přítomnost DNA HPV ve vzorcích biopsie genitálního karcinomu sama o sobě nedokazuje etiologickou účast těchto virových infekcí, i když zjevná nádorová specifita HPV 16 takové roli nasvědčuje. Jejich biologický význam, stejně jako předpokládaná interakce s iniciačními událostmi, jistě vyžadují další zkoumání.“
Růžová… protože, víte… rakovina děložního čípku…
SHRNUTÍ:
- Harald zur Hausen začal své pátrání hledáním „virů“ v lidských genitálních bradavicích, což vedlo k objevu nového typu „papilomaviru“, který nazval HPV-6.
- K jeho velkému zklamání se jeho týmu nepodařilo najít HPV-6 v žádném vzorku rakoviny děložního čípku, ale přivedlo ho to k blízce příbuznému „papilomaviru“, který nakonec pojmenoval HPV-11.
- V roce 1983 zur Hausen publikoval důkazy, že HPV-11 byl přítomen ve 3 z 24 vzorků rakoviny děložního čípku, které testoval.
- Pokračoval v pátrání a objevil HPV-16, který byl zjištěn přibližně v polovině případů rakoviny děložního čípku, dále HPV-18, přítomný přibližně v 1 z 5 vzorků rakoviny děložního čípku.
- Tento objev vyvolal v té době – na počátku 80. let 20. století – značný rozruch, protože většina odborníků nevěřila, že by „viry“ mohly způsobovat rakovinu.
- Za tento objev získal v roce 2008 polovinu Nobelovy ceny za fyziologii a medicínu, o kterou se podělil se dvěma francouzskými vědci, kteří objevili „virus“ lidské imunodeficience (HIV) (to by mělo být vše, co člověk potřebuje vědět).
- V prohlášení k Nobelově ceně se uvádí, že dr. zur Hausen šel „proti tehdejšímu dogmatu“ a jeho návrh na roli HPV v rakovině děložního čípku byl v rozporu s převládajícími názory v 70. letech 20. století.
- „Můj návrh nebyl v té době příliš vítán,“ vzpomínal Harald zur Hausen v jednom rozhovoru.
- V té době se pozornost mnoha vědců soustředila na „virus“ herpes simplex.
- Nějakou dobu trvalo, než se na podporu tohoto návrhu podařilo shromáždit důkazy.
- Harald zur Hausen předpokládal, že pokud nádorové buňky obsahují onkogenní „virus“, měly by mít ve svém genomu integrovanou „virovou“ DNA.
- Trvalo však více než 10 let, než se to podařilo prokázat, protože proces byl komplikován tím, že do genomu hostitele byly integrovány pouze části „virové“ DNA.
- Jeho tým nalezl v biopsiích rakoviny děložního čípku novou DNA HPV (tj. nikoliv „virus“, ale jeho předpokládanou DNA), a tak v roce 1983 „objevil“ nádorový „virus“ typu HPV 16.
- O rok později jeho tým naklonoval HPV 16 a HPV 18 od pacientek s rakovinou děložního čípku (kde byly HPV 16 a 18 někdy purifikovány a izolovány?).
- HPV 16 a 18 byly trvale nalézány přibližně v 70 % biopsií karcinomu děložního čípku na celém světě (tj. v biopsiích se našla DNA, o které se předpokládalo, že je „virová“, ale nikdy se neprokázalo, že je „virová“).
- Nobelův výbor byl ve svých předpovědích ohledně dopadu vakcíny opatrný a poznamenal, že „může snížit potřebu chirurgických zákroků a globální zátěž rakovinou děložního čípku.“
- Dr. Markman uvedl, že se „poprvé podařilo jednoznačně definovat infekční agens jako příčinu vzniku rakoviny, ukázat proces, kterým virová DNA ovlivňuje vznik rakoviny, a nakonec i to, jak by vakcína mohla potenciálně zabránit vzniku rakoviny.“
- Tato myšlenka byla natolik revoluční, že trvalo poměrně dlouho, než byl tento objev mezi vědeckou komunitou přijat.
- Mnozí odborníci nemohli uvěřit tomu, že by „virus“ mohl způsobit rakovinu, a místo toho se zaměřovali na jiné faktory prostředí a genetické predispozice.
- „Trvalo dalších deset let, než byla většina skeptiků umlčena, a ještě před několika lety se našlo několik vzdorujících starších lékařů a vědců.“ (umlčet neznamená dokázat, že se mýlí).

- V roce 1949 Maurice Strauss, Henry Bunting a Joseph Melnick publikovali studii o pozorování „virům podobných“ tělísek získaných z kožních papilomů pomocí elektronového mikroskopu.
- Elektronovou mikroskopií bylo studováno pět takových lézí.
- Polovina každé léze byla fixována ve formalínu pro tkáňové řezy, zatímco zbytek byl okamžitě rozmělněn s oxidem hlinitým a destilovanou vodou a vyčištěn pomocí centrifugace tekutiny supernatantu při 2 000 otáčkách za minutu po dobu 5 minut, po níž následovala centrifugace vzniklé tekutiny supernatantu při 6 000 otáčkách za minutu po dobu 15 až 45 minut.
- Byly stínovány chromem pod úhlem 1:7.
- Výsledné uspořádání se podobalo uspořádání, které bylo dříve zaznamenáno u krystalických rostlinných „virů“.
- Pátrání v nashromážděném materiálu laboratoře chirurgické patologie nemocnice v New Havenu odhalilo 31 dalších kožních lézí histologicky podobných výše popsaným papilomům s inkluzními tělísky.
- Vědci došli k závěru, že při studiu suspenzí 5 kožních papilomů byly elektronovou mikroskopií pozorovány částice „podobné virům“, které mají tendenci být uspořádány do krystalického vzoru.

- Maurice Strauss, Henry Bunting a Joseph Melnick ve své práci z roku 1952 uvádějí, že jejich práce na lidském papilomu byla provedena konvenčním způsobem, tj. izolací buněčných složek (tj. nikoli „virů“) diferenciální centrifugací a jejich zkoumáním v elektronovém mikroskopu.
- Opět vidíme, že materiál z papilomů a z kontrolních vzorků byl rozmělněn s oxidem hlinitým a destilovanou vodou, odstředěn při 2000 otáčkách za minutu po dobu 5 minut a získaná tekutina supernatantu byla podrobena dalšímu odstřeďování při 6000 otáčkách za minutu po dobu 45 minut.
- Sediment byl resuspendován v malém objemu destilované vody (asi 1 ml).
- Malá kapka byla umístěna na kolodiové stínítko elektronového mikroskopu a před zkoumáním byla zastíněna chromem nebo palladiem.
- Přestože izolované částice lze nalézt ve všech vzorcích, částice jsou uspořádány do krystalických shluků s takovou pravidelností, že se toto uspořádání jeví jako charakteristické.
- Jinými slovy, nezkoumali purifikované/izolované vzorky.
- Histologický vzhled papilomů produkujících částice „podobné virům“ byl podrobně popsán v práci Buntinga a Strausse.
- Absolutní identifikace intranukleárních inkluzních tělísek ve Feulgenových preparátech, aby nedošlo k záměně s hmotou chromatinu, byla zajištěna porovnáním s kresbami a kodachromy stejných buněk při předchozím barvení hematoxylinem a eosinem.
- Pokud existovala možnost záměny s hmotou chromatinu, je to další důkaz, že vzorek obsahoval více než předpokládané „virové“ částice.
- Mikrofotografie byly pořízeny při vlnových délkách 2650 a 2800 Å a hodnoceny vizuálně.
- Domnívali se, že tato charakteristická částice je pravděpodobně „virové“ povahy a je odpovědná za vznik a růst bradavic.
- Tvrdí, že v minulosti bylo zjištěno, že takové krystalické vzory vytvářejí sférické „viry“ (s tím, že stejný nedostatek purifikace, izolace a důkazu patogenity lze aplikovat i na tyto částice).
- Skutečnost, že relativně nečisté preparáty suspenzí těchto bradavic dávají takové obrazce, ukazovala na výrazný stupeň vzájemného vztahu těchto částic a jejich uniformitu (tj. další přiznání, že částice představující HPV byly vybrány z nepurifikovaného zdroje).
- Charakteristické histopatologické změny pozorované u těchto lézí, které se nevyskytují u všech běžných bradavic, byly zřejmě spojeny s přítomností částic „podobných virům“.
- Eozinofilní intranukleární inkluzní tělíska pravděpodobně svědčila o přítomnosti „viru“.
- Výsledkem této studie je to, že tři vědci vybrali reprezentativní částice z nečistých zdrojů a bez důkazů jim přiřadili histologické účinky.

- DNA z jednoho vzorku biopsie invazivního karcinomu děložního čípku obsahovala sekvence hybridizující s DNA lidského papilomaviru (HPV) typu 11 pouze za málo přísných podmínek.
- Za přísných podmínek hybridizace zkříženě hybridizovala v malé míře (méně než 0,1 %) s HPV typy 10, 14 a 15 a nevykazovala žádnou homologii s DNA jiných lidských typů HPV.
- DNA HPV 16 byla použita jako sonda k testování dalších vzorků z nádorových biopsií.
- Pouze 2 z 33 vzorků condylomata acuminata obsahovaly DNA HPV 16.
- Oba pozitivní nádory navíc obsahovaly DNA HPV 6 nebo HPV 11.
- Údaje tedy naznačují, že v maligních nádorech převažuje DNA HPV 16, což činí náhodnou kontaminaci papilomavirovou DNA ze sousedních papilomů (tj. nejedná se o purifikovaný vzorek) spíše nepravděpodobnou.
- Vzácná přítomnost u benigních genitálních papilomů (tj. nekancerózních) spolu s běžnými genitálními papilomaviry naznačuje závislost replikace HPV 16 na pomocném „viru“.
- Zur Hausen tvrdil, že přibývá důkazů, že „papilomaviry“ se mohou podílet na etiologii některých druhů rakoviny u zvířat a lidí.
- Společným rysem maligní konverze po infekci „papilomaviry“ je, že zřejmě vyžaduje další interakci s iniciačními událostmi.
- Bylo zjištěno, že u rakoviny hrají roli dvě skupiny „virů“: „viry“ herpes simplex a lidské „papilomaviry“ (HPV).
- Zur Hausenova skupina konzistentně nebyla schopna detekovat DNA herpes simplex ve vzorcích biopsie karcinomu děložního čípku (možná proto, že nikdy nebylo prokázáno, že DNA pochází z purifikovaného/izolovaného „viru“ herpes simplex?).
- Zaměřili tedy svoji pozornost na perzistenci DNA „papilomaviru“ (u níž rovněž nebylo nikdy prokázáno, že pochází z purifikovaných/izolovaných částic „viru“) v genitálních nádorech.
- V rámci benigních genitálních nádorů mohou existovat další typy HPV.
- Green a kol. uvedli, že 2 z 31 karcinomů děložního čípku a 2 z 10 karcinomů vulvy obsahovaly sekvence související s „virem“, který pravděpodobně představuje HPV 10.
- Gissmann a kol. detekovali DNA zkříženě reagující s DNA HPV 6 nebo HPV 11 nebo DNA s ní identickou v 6 nádorech Buschke-Lowenstein (nemetastazující verukózní karcinomy) a v 5 z 27 bioptických vzorků karcinomu děložního čípku.
- Zur Hausen uvedl, že v jeho studii byla DNA hybridizující s HPV 11 za málo přísných podmínek v jednom z těchto nádorů molekulárně klonována a použita jako sonda pro testování benigních a maligních genitálních nádorů na přítomnost homologních sekvencí.
- Údaje odhalují překvapivou prevalenci této DNA v maligních nádorech a její velmi sporadickou přítomnost v benigních papilomech (tj. DNA byla nalezena i v nekancerózních nálezech).
- DNA byla připravena extrakcí pomocí fenolu/chloroformu/isoamylalkoholu podle popisu.
- Asi 10 µg nádorové DNA bylo rozštěpeno pomocí různých restrikčních endonukleáz, separováno na agarózových gelech a přeneseno na nitrocelulózové filtry.
- Hybridizace byla provedena v 0,75 M NaCl/0,075 M citrátu sodném a různých koncentracích formamidu při 42 °C s tRNA místo DNA telecího thymu jako nosičem.
- DNA HPV značená 32P klonovaná v plazmidu pBR322 byla před nick-translací purifikována z vektoru elektroforézou.
- Filtry byly promyty v 0,30 M NaCl/0,03 M citrátu sodném/0,1% dodecylsulfátu sodném při příslušné hybridizační teplotě.
- DNA HPV z karcinomu děložního čípku (laboratorní kód WV 2916) byla klonována v bakteriofágu λ L 47 v jediném místě BamHI a subklonována v pBR322 (běžně používaný plazmidový klonovací vektor u E. coli).
- Při screeningu velkého počtu karcinomů děložního čípku za málo přísných podmínek hybridizace (nepublikované údaje) s DNA HPV 11 bylo zjištěno, že jeden nádor (WV 2916) obsahuje papilomavirové sekvence s neobvyklým štěpným vzorem Pst I, které nebyly detekovatelné za přísných podmínek.
- Konstrukce genomové knihovny a následný screening plaků s DNA HPV 11 značenou 32P za málo přísných podmínek vedly k získání řady rekombinantních (různé zdroje kombinované DNA) fágů obsahujících fragment 7,2 kb.
- Pozn.: Molekuly rekombinantní DNA (rDNA) jsou molekuly DNA vytvořené laboratorními metodami genetické rekombinace (jako je molekulární klonování), které spojují genetický materiál z více zdrojů a vytvářejí sekvence, které by se jinak v genomu nenacházely.
https://en.m.wikipedia.org/wiki/Recombinant_DNA - Charakterizace této DNA nebyla v této studii uvedena.
- Fragment o velikosti 7,2 kb byl subklonován v pBR322 a charakterizován pomocí různých restrikčních enzymů (nepublikované údaje).
- Další fragmenty nebyly touto sondou detekovány, což svědčí o heterogenitě (tj. nejsou stejné) sekvencí HPV u tohoto karcinomu děložního čípku.
- Blotová hybridizace 7,2 kb fragmentu s DNA dosud charakterizovaných typů lidských papilomavirů za přísných podmínek vedla k pozitivní reakci pouze u HPV 10, 14 a 15 (G. Orth, osobní sdělení) a jednoho dosud neklasifikovaného izolátu od pacientky s epidermodysplasia verruciformis (G. Orth, osobní sdělení) (jinými slovy, opět nepublikované údaje).
- Byl proto učiněn závěr, že 7,2 kb fragment z DNA WV 2916 představuje další typ „papilomaviru“, předběžně označený jako HPV 16.
- DNA HPV 16 purifikovaná z vektoru byla použita jako sonda pro screening řady genitálních bradavic, dysplazií a karcinomů in situ, jakož i invazivně rostoucích genitálních karcinomů.
- Jinými slovy, ke screeningu vzorků rakoviny použili neznámou sekvenci DNA, kterou vytvořili a o níž předpokládali, že se jedná o nový HPV.
- 11 z 18 karcinomů děložního čípku od německých pacientek obsahovalo sekvence specifické pro HPV 16.
- DNA pouze z 8 z 23 bioptických vzorků získaných z Afriky a Jižní Ameriky reagovala za přísných podmínek s DNA HPV 16.
- Vyšší procento negativních nádorů, které nepocházely z Evropy (65,2 %), a materiálů obsahujících detekovatelné koncentrace různých papilomavirů (8,7 %) naznačuje, že v nádorech pacientů z těchto oblastí mohou převažovat jiné typy „virů“.
- Pouze 2 z 33 (6,1 %) genitálních bradavic však obsahovaly DNA HPV 16, jak bylo stanoveno podle charakteristického vzoru štěpení Pst I.
- Zajímavé je, že tyto dva nádory rovněž obsahovaly DNA HPV 6 nebo HPV 11.
- Charakterizace typů „papilomavirů“ byla založena výhradně na analýze DNA po molekulárním klonování.
- Mnohé z klasifikovaných typů byly identifikovány pouze z nádorové DNA nesoucí tyto genomy a dosud nebyly prokázány v částicích „papilomaviru“.
- Jinými slovy, vše, co se týká HPV, je založeno na náhodné DNA, kterou nelze spojit s částicemi „viru“.
- DNA HPV 16 se v nádoru vyskytuje v extrachromozomálním stavu (nepublikované údaje).
- Zur Hausen uvedl, že přítomnost této DNA ve více než 60 % (tj. ne ve všech případech) bioptických vzorků karcinomu děložního čípku od německých pacientek a její nepřítomnost u většiny benigních papilomů (tj. vyskytuje se u nekancerózních případů) ze stejné oblasti je překvapivým zjištěním.
- To činí náhodnou kontaminaci ze sousední tkáně papilomu spíše nepravděpodobnou (opět se jedná o nepurifikované vzorky).
- Ačkoli HPV 16 existuje v těchto lézích výhradně jako cirkulární molekuly monomerní délky (nepublikované údaje), lze spekulovat o tom, že DNA HPV 16 je defektní a pro enkapsidaci částic a infekčnost vyžaduje komplementaci dalšími typy „papilomavirů“.
- DNA vykazovala v nádorové tkáni určitou heterogenitu (tj. nebyla stejná), což naznačuje buď existenci různých podtypů, nebo změnu uspořádání genomu během vývoje rakoviny.
- Zur Hausen připustil, že existují určité geografické rozdíly ve výskytu infekce HPV 16 u rakoviny lidských pohlavních orgánů, neboť pouze 34,8 % vzorků biopsie rakoviny děložního čípku získaných z Keni a Brazílie obsahovalo zkřížené hybridizující sekvence.
- Uvedl, že to může odrážet výskyt jiných typů „papilomavirů“ v těchto oblastech:
- HPV 6 u Buschkeho-Lowensteinových nádorů nebo verukózních karcinomů vulvy a penisu
- DNA „viru“ pravděpodobně identického s HPV 10 u 2 z 31 karcinomů děložního čípku a u 2 z 10 karcinomů vulvy
- DNA HPV 11 u několika karcinomů děložního čípku
- Celkové procento pozitivních bioptických vzorků karcinomu děložního čípku (německé případy) činilo 72 % (celkem všechny zjištěné HPV, nejen HPV 16).
- Očekával, že charakterizace dalších typů HPV zvýší procento pozitivních nádorů.
- Zur Hausen dospěl k závěru, že pravidelná přítomnost DNA HPV ve vzorcích biopsie genitálního karcinomu sama o sobě nedokazuje etiologickou účast těchto „virových“ infekcí, i když zjevná nádorová specificita HPV 16 takové roli nasvědčuje.
- Konstatoval, že jejich biologický význam i předpokládaná interakce s iniciačními událostmi jistě vyžadují další zkoumání.

„Téměř všechny“. Co je příčinou ostatních případů rakoviny děložního čípku, když ne HPV?
Zur Hausenova studie je mikrokosmem toho, co je ve virologii špatně. Předpokládal, že „virus“ může způsobit rakovinu děložního čípku. Předpokládal, že je to HPV. Přestože DNA, kterou nalezl, zkříženě hybridizovala s HPV 10, 14 a 15 v méně než 0,1 % a nesdílela žádnou homologii s žádným jiným HPV, předpokládal, že objevil HPV-16. Když použil DNA HPV-16 ke zkoumání důkazů, našel ji pouze v některých (ne ve všech) případech rakoviny děložního čípku, které se velmi lišily podle zeměpisné polohy, a přesto stále předpokládal, že je příčinou rakoviny.
Když pak výzkumník, který všechny tyto věci považuje za pravdivé, ve své vlastní práci přizná, že:
- Charakterizace typů „papilomavirů“ byla založena výhradně na analýze DNA po molekulárním klonování
- Mnohé z klasifikovaných typů byly identifikovány pouze z nádorové DNA nesoucí tyto genomy a dosud nebyly prokázány v částicích „papilomaviru“
- Nález DNA údajně spojené s HPV nedokazuje, že HPV způsobuje rakovinu, s níž je spojován
- Bylo vyžadováno další zkoumání biologického významu i předpokládané interakce s iniciačními událostmi
potom jsou s uvedenými důkazy docela velké problémy.
Jediné, co lze tvrdit, je identifikace náhodné DNA, o níž se předpokládá, že je „virová“, aniž by to bylo podloženo jakýmikoli purifikovanými a izolovanými fyzikálními částicemi. Možná právě proto byli současníci Haralda zur Hausena k jeho zjištěním a k souvislosti mezi rakovinou a „viry“ skeptičtí. Tedy dokud nebyli umlčeni.