Během posledních několika desetiletí se ukázalo, že ve vědě dochází k obrovské krizi reprodukovatelnosti. Na to skvěle poukázal John Ioannidis, velmi uznávaný lékař a vědec, profesor na Stanfordu, který ve své eseji z roku 2005 dospěl k závěru, že většina publikované vědecké literatury je chybná. Jedním z důvodů je nedostatečná reprodukovatelnost a replikace:
„Několik metodologů poukázalo na to, že vysoká míra nereplikovatelnosti (nedostatečného potvrzení) výzkumných objevů je důsledkem pohodlné, ale špatně podložené strategie tvrzení o přesvědčivých výsledcích výzkumu pouze na základě jediné studie.“
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1182327/
V průběhu let se ukázalo, že nedostatek reprodukovatelnosti byl zjištěn v mnoha oblastech souvisejících s virologií, včetně buněčných kultur, genomiky a PCR. Pokud tedy víme, že většina vědecké literatury je chybná a zasahuje do mnoha oblastí, které virologie zahrnuje, nemělo by být žádným překvapením, že k této krizi reprodukovatelnosti dochází i ve světě protilátek.
Níže jsou uvedeny hlavní body ze 4 článků, které podrobně popisují krizi reprodukovatelnosti týkající se protilátek. Důkazy byly poprvé předloženy v roce 2015 a zařadil jsem i články z posledních několika let, abych ukázal, že od té doby nedošlo k žádnému zlepšení.
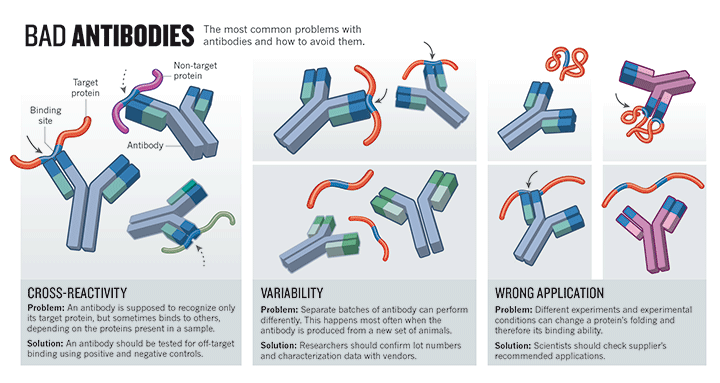
Prvním zdrojem je článek v časopise Nature z května 2015. Přímo poukazuje na to, že důvodem nedostatečné reprodukovatelnosti a replikovatelnosti v biologických oborech je výzkum protilátek. Autor uvádí mnoho příkladů od různých vědců, jak nedostatek specificity, považované za základní vlastnost protilátek, vytváří nereprodukovatelné výsledky a chybná zjištění. Článek pojednává o chybějící standardizaci a kontrole kvality ve výzkumu protilátek a podrobně popisuje roli, kterou mají výrobci na variabilitě prodávaných a používaných protilátek, což vede k plýtvání časem a zdroji v důsledku mnoha neúspěšných experimentů:
Krize reprodukovatelnosti: Vina je na protilátkách
„Protilátky jsou hybnou silou biologických experimentů, avšak tuto oblast zamořují chybnými nálezy. Několik reformátorů prosazuje změnu.
V roce 2006 to pro Davida Rimma, patologa z Yale University v New Havenu ve státě Connecticut, vypadalo docela dobře. Vyvinul test, který měl vést k účinné léčbě rakoviny kůže – melanomu a který byl příslibem záchrany životů. Základem testu byly protilátky – velké bílkoviny ve tvaru písmene Y, které se vážou na určité biomolekuly a mohou být použity k označení jejich přítomnosti ve vzorku. Rimm nalezl kombinaci protilátek, která po ‚obarvení‘ biopsie nádorů vytvořila vzorec, který ukázal, zda pacient bude muset užívat určité drastické léky, aby se zabránilo recidivě po operaci. Získal finanční prostředky ve výši více než 2 miliony dolarů, aby mohl tento test použít v klinické praxi.
V roce 2009 se ale vše začalo hroutit. Když si Rimm objednal novou sadu protilátek, jeho tým nedokázal původní výsledky reprodukovat. Protilátky prodávaly stejné společnosti jako původní šarže a měly být identické – neposkytovaly však stejné vzorce barvení, dokonce ani na stejných nádorech. Rimm byl nucen práci na sadě protilátek proti melanomu vzdát. ‚Dostali jsme lekci: neměli jsme se na ně spoléhat,‘ řekl. ‚Bylo to velmi smutné laboratorní setkání.‘
Protilátky patří k nejčastěji používaným nástrojům v biologických vědách – používají se v mnoha experimentech k identifikaci a izolaci dalších molekul. Nyní je však jasné, že patří také mezi nejčastější příčiny problémů. Variabilita mezi jednotlivými šaržemi, kterou Rimm zažil, může vést k dramaticky odlišným výsledkům. Ještě větším problémem je, že protilátky často rozpoznávají další bílkoviny kromě těch, k jejichž detekci jsou prodávány. To může způsobit, že se od projektů upustí, a tím se ztrácí čas, peníze i vzorky.
Mnozí se domnívají, že protilátky jsou hlavním důvodem toho, co je považováno za ‚krizi reprodukovatelnosti‘, tedy rostoucího uvědomění, že výsledky mnoha biomedicínských experimentů nelze reprodukovat a že závěry na nich založené mohou být neopodstatněné. Špatně charakterizované protilátky pravděpodobně přispívají k tomuto problému více než jakýkoli jiný laboratorní nástroj, říká Glenn Begley, vědecký ředitel společnosti TetraLogic Pharmaceuticals v Malvernu v Pensylvánii a autor kontroverzní analýzy, která ukázala, že výsledky 47 z 53 stěžejních prací o výzkumu rakoviny nelze reprodukovat.
Několik vědců, kteří na špatné zkušenosti s protilátkami doplatili, se začalo ozývat. Rimmovo zklamání ho přimělo ke křížové výpravě za osvětou ostatních psaním recenzí, pořádáním webových seminářů a upozorňováním na problém v nesčetných konferenčních přednáškách. On a další volají po vytvoření standardů, podle kterých by se měly protilátky vyrábět, používat a popisovat. A vzniklo asi půl tuctu iniciativ řadových vědců, které se snaží zajistit lepší způsoby hodnocení kvality protilátek.“
Kupující, mějte se na pozoru
„Vezměme si příklad Ioannise Prassase, výzkumníka v oblasti proteomiky v nemocnici Mount Sinai v kanadském Torontu. On a jeho kolegové se zabývali proteinem CUZD1, o kterém se domnívali, že by se dal použít k testování, zda má někdo rakovinu slinivky. Koupili sadu na detekci proteinu a promarnili dva roky, 500 000 dolarů a tisíce vzorků pacientů, než zjistili, že protilátka v sadě rozpoznává jiný rakovinový protein, a to CA125, a vůbec se neváže na CUZD1. Zpětně Prassas říká, že spěch, se kterým se pustili do nadějné hypotézy, znamenal, že on a jeho skupina neprovedli všechny správné testy. Když někdo řekne: ‚Tady je test, který můžete použít,‘ jste tak dychtiví ho vyzkoušet, že můžete zapomenout, že to, co bylo slíbeno, není pravda.
Většina vědců, kteří nakupují protilátky, věří štítku na lahvičce, říká Rimm. ‚Jako patolog jsem nebyl vyškolen, že musíte protilátky validovat. Byl jsem vyškolen pouze v tom, že si je objednáte.‘ “
„Od 70. let 20. století vědci využívají protilátky pro výzkum. Když vědec injekčně aplikuje králíkovi zkoumaný protein, bílé krvinky známé jako B-lymfocyty začnou produkovat protilátky proti tomuto proteinu a ty lze z krve zvířete odebrat. Pro získání konzistentnějšího produktu lze B-lymfocyty odebrat, spojit je s ‚nesmrtelnou‘ buňkou a kultivovat, čímž se zajistí teoreticky neomezená zásoba.
Před třemi desetiletími si vědci, kteří potřebovali pro své experimenty protilátky, museli tyto protilátky vyrábět sami. Koncem devadesátých let však tuto práci začaly přebírat firmy vyrábějící činidla.
V dnešní době prodává více než 300 společností přes 2 miliony protilátek pro výzkum. Podle mezinárodní poradenské společnosti Frost & Sullivan měl tento trh v roce 2011 hodnotu 1,6 miliardy dolarů.
Devastující dopady
„Existují známky toho, že problémy s protilátkami mají rozsáhlé a potenciálně devastující dopady na výsledky výzkumu. V roce 2009 věnoval jeden vědecký časopis celé číslo hodnocení protilátek, které se používají ke studiu receptorů spřažených s G-proteiny (GPCR) – buněčných signálních proteinů, na které se zaměřují léky k léčbě různých poruch, od inkontinence po schizofrenii. Při analýze 49 komerčně dostupných protilátek, které se zaměřovaly na 19 signálních receptorů, se většina z nich vázala na více než jeden protein, což znamená, že se jim nedá důvěřovat v tom, že by rozlišovaly jednotlivé receptory.
Oblast epigenetiky se při zjišťování, jak byly změněny proteiny regulující genovou expresi, do značné míry spoléhá na protilátky. V roce 2011 bylo při hodnocení 246 protilátek používaných v epigenetických studiích zjištěno, že jedna čtvrtina z nich selhala v testech specificity, což znamená, že se často vázaly na více než jeden cíl. Čtyři protilátky byly dokonale specifické – ale na nesprávný cíl.
Vědci údajně často vědí, že některé protilátky v jejich oboru jsou problematické, ale je obtížné posoudit velikost tohoto problému v celé biologii. Snad nejrozsáhlejší hodnocení pochází z práce, kterou zveřejnilo švédské konsorcium Human Protein Atlas, jehož cílem je vytvořit protilátky pro každý protein v lidském genomu. Zatím prozkoumalo přibližně 20 000 komerčních protilátek a zjistilo, že ke zkoumání distribuce proteinů v konzervovaných řezech tkáně lze efektivně použít méně než 50% z nich. To vedlo některé vědce k tvrzení, že až polovina všech komerčně dostupných protilátek je nespolehlivá.
Spolehlivost však může záviset na experimentu. ‚Naše zkušenost s komerčními protilátkami je taková, že v některých aplikacích jsou obvykle v pořádku, ale v jiných mohou být hrozné,‘ říká Mathias Uhlén z Royal Institute of Technology ve Stockholmu, který koordinuje projekt Human Protein Atlas.
V ideálním případě by si vědci měli ověřit, zda byla protilátka testována pro použití v konkrétních aplikacích a typech tkání, ale kvalita informací poskytovaných prodejci se může velmi lišit. Vědci si často stěžují, že společnosti neposkytují údaje potřebné k vyhodnocení specificity dané protilátky nebo její variability mezi jednotlivými šaržemi. Společnosti mohou dodávat šarže protilátek s charakterizačními informacemi odvozenými z předchozí šarže. A údaje jsou často získány za ideálních podmínek, které neodrážejí typické experimenty. Společnosti vyrábějící protilátky, které byly osloveny pro tento článek, uvedly, že není možné testovat jejich produkty za všech experimentálních podmínek, ale že poskytují spolehlivé údaje a spolupracují s vědci na zlepšení kvality a výkonnosti protilátek.
Mnoho vědců používá k vyhledávání produktů Google, takže optimalizace výsledků vyhledávání může mít někdy pro společnost větší význam než optimalizace samotných činidel, uvedl Tim Bernard, vedoucí biotechnologické poradenské společnosti Pivotal Scientific v Upper Heyfordu ve Velké Británii. Christi Birdová, analytička společnosti Frost & Sullivan z Washingtonu DC, říká, že vědce často více zajímá, jak rychle mohou být činidla dodána, než hledání protilátek s vhodnými validačními údaji. ‚Je to efekt Amazonu: chtějí to do dvou nebo tří dnů s dopravou zdarma.‘
Výzkumníci, kteří si problém s protilátkami uvědomují, tvrdí, že vědci musí být ostražitější. ‚Protilátky nejsou kouzelná činidla. Nemůžete je jen tak použít na vzorek a očekávat, že výsledek, který dostanete, bude stoprocentně spolehlivý, aniž byste do toho vložili trochu kritického myšlení,‘ říká James Trimmer, vedoucí společnosti NeuroMab na Kalifornské univerzitě v Davisu, která vyrábí protilátky pro neurovědy. Stejně jako mnoho jiných dodavatelů i NeuroMab výslovně uvádí typy experimentů, pro které by měla být protilátka použita, ale vědci ne vždy pokyny dodržují.“
„Mnozí výzkumníci se při hledání rad spoléhají na ústní sdělení nebo na publikovanou literaturu. To však vytváří neustále se opakující problém a lepší protilátky, které jsou k dispozici později, se používají jen zřídka, říká Fridtjof Lund-Johansen, výzkumný pracovník v oblasti proteomiky na Univerzitě v Oslu. ‚Na trhu máme velmi dobré protilátky,‘ říká, ‚ale nevíme, jaké jsou.‘ Lund-Johansen se to snaží změnit vývojem vysoce výkonných testů, které by mohly porovnávat tisíce protilátek najednou.“
„Někteří vědci volají po mnohem radikálnější změně. Andrew Bradbury z Los Alamos National Laboratory v Novém Mexiku a více než 100 spolusignatářů navrhli v únorovém komentáři v časopise Nature rozsáhlou změnu ve způsobu výroby a prodeje protilátek. Navrhli, aby se používaly pouze protilátky, které byly definovány až na úroveň sekvence DNA, která je produkuje, a poté vyráběny v upravených ‚rekombinantních‘ buňkách. Tím by se obešla značná část variability, která vzniká při výrobě protilátek na zvířatech. Návrh však vyžaduje informace o jednotlivých protilátkách, které mnoho společností považuje za obchodní tajemství – a trh s protilátkami a jeho miliony produktů by musel být v podstatě zničen a rekonstruován.“
„Tlak na charakterizaci v současnosti dostupných protilátek roste. V rámci snah o zlepšení reprodukovatelnosti začali někteří výzkumní pracovníci diskutovat o zapojení nezávislého orgánu do vytvoření certifikačního programu pro komerční protilátky. A několik časopisů (včetně Nature) žádá autory, aby jasně uváděli, že protilátky použité v jejich vědeckých pracích byly profilovány pro danou aplikaci.
Podle Trimmera se kvalita bude spíše postupně zlepšovat, než aby se zvýšila skokově, a doufá, že se vytvoří pozitivní zpětná vazba: jakmile si vědci uvědomí artefakty, budou s větší pravděpodobností zpochybňovat výsledky a odhalovat další artefakty. Již nyní se podle něj začíná vytrácet všeobecná neochota validovat protilátky. ‚Trochu se to obrací,‘ říká. ‚Musíme o tom dál mluvit.‘ “
https://www.nature.com/news/reproducibility-crisis-blame-it-on-the-antibodies-1.17586

Další článek je ze září 2019 a zabývá se otázkou, kdo je za krizi reprodukovatelnosti protilátek odpovědný, a řeší dopad, který mají výrobci kvůli nekonzistentním šaržím a variabilitě mezi jednotlivými šaržemi. Pojednává o důležitosti správné charakterizace a validace protilátek a antigenů:
Validace protilátek… Přetrvává ještě krize?
„Spolehlivé protilátky jsou zásadní: ať už plánujete publikovat průlomový výzkum, nebo provádíte rutinní testy ve své laboratoři, reprodukovatelnost je klíčová.
V průběhu let se hodně diskutovalo o tom, kdo by měl převzít odpovědnost za validaci protilátek. Je odpovědností dodavatele protilátek nabídnout plně charakterizovanou a validovanou protilátku, nebo by měl výzkumník validovat protilátku specificky pro své vlastní potřeby? Zpočátku byla větší odpovědnost za kontrolu protilátky, zda v jejich testech funguje tak, jak má, na výzkumných pracovnících. Současný názor klade větší povinnost na výrobce protilátek, aby zajistil konzistenci jednotlivých šarží a specificitu cíle, na který se protilátka váže. V rámci našeho průzkumu o stavu tohoto výrobního odvětví, zveřejněného v naší zprávě o trhu s protilátkami v roce 2019, jsme se dotazovali samotných výrobců na jejich názory na validaci protilátek. Větší procento výrobců se ve srovnání s předchozím rokem domnívalo, že validace protilátek je problémem, který by mělo výrobní odvětví řešit. V průzkumu z roku 2018 si myslelo, že se jedná o problém výrobního odvětví, pouze 45,8% dotázaných společností, zatímco v roce 2019 to bylo 57,6%. Na otázku, jakým způsobem by bylo možné zlepšit standardy kvality, 37% respondentů navrhlo zavedení globálních standardů.“
„Větší otřes trhu s výzkumnými činidly představila publikace Bradburyho a Pluckthuna ve vědeckém časopise Nature. Bradbury, Pluckthun a 110 spolusignatářů požadovali financování, které by umožnilo genetické sekvenování všech monoklonálních protilátek produkovaných hybridomy proti klíčovým cílům. Popsali nejednotnou úroveň charakterizace mezi jednotlivými výrobci a potenciální problémy spojené s hybridomy. Navrhli, že nahrazení těchto protilátek rekombinantními verzemi by zajistilo nikdy nekončící přísun vysoce charakterizovaných protilátek. Podporovali tak přechod k výhradnímu používání rekombinantních protilátek, a dokonce navrhovali úplné vyřazení polyklonálních protilátek!
Na 3. mezinárodním setkání pro validaci protilátek, které se konalo v Bathu, byl rovněž zdůrazněn význam antigenů při tvorbě, charakterizaci a validaci protilátek. Řečníci zdůraznili, že pro efektivní tvorbu protilátek je nutné, aby se jednalo o proteiny plné délky, správně složené a ‚autentické‘. Dále se diskutovalo o faktorech, jako je množství a dostupnost antigenů, které by měly být zohledněny při plánování strategie charakterizace a validace protilátek. Nebyla opomenuta ani úloha vědců, kteří tyto protilátky nakupují, s důrazem na správné použití, protože výkonnost protilátek je závislá na aplikaci.“
Antibody Validation… Is There Still A Crisis?

Všechny tyto vědecké práce by měly být staženy.
Tento druhý článek v časopise Nature je ze září 2020. Upozorňuje na problémy související s nespecificitou protilátek, které se vážou na jiné než zamýšlené proteiny. Uvádí příklady toho, jak je tato nespecificita protilátek mezi výzkumníky konzistentním zjištěním, které vede k nereprodukovatelným a chybným výsledkům. Pojednává o krizi identity ve výzkumu protilátek, protože není jasné, které protilátky jsou v mnoha publikovaných pracích použity, a vyzývá vědeckou komunitu, aby byla ke všem výsledkům výzkumu protilátek skeptická:
Když protilátky klamou: hledání validace
„Komerční protilátky jsou v biologických laboratořích běžné. Vědci používají tyto obří proteiny ve tvaru písmene Y k detekci specifických molekul v buňkách, tkáních a zkumavkách. Někdy však tyto proteiny detekují i jiné molekuly – nebo dokonce místo nich. Když k tomu dojde, chyb může výrazně přibývat.“
„Peter McPherson, neurolog z McGill University v kanadském Montrealu, má podezření, že vícenásobné umístění pramení z toho, co je často považováno za triviální rozhodnutí pro detekci proteinu: výběr protilátky. Protilátky fungují tak, že se vážou na specifické části proteinu podle jeho tvaru a chemických vlastností, ale protilátka vyrobená pro vazbu na jeden protein se často může vázat na jiný a někdy s lepší afinitou.
To potvrzuje i McPhersonova práce. On a jeho tým zakoupili 16 protilátek, které se prodávají za účelem detekce CR9ORF72. Poté vzali buněčnou linii, která produkuje protein ve vysokém množství, a pomocí nástroje pro úpravu genomu CRISPR-Cas9 vytvořili linii, v níž byl protein CR9ORF72 vyřazen, takže protein se v ní nevyskytoval. Poté vyhodnotili, jak si protilátky vedly v obou liniích v řadě běžných testů, a zjistili, že protilátka, která byla použita ve většině publikací (a nejčastěji citována), našla protein, i když tam nebyl. Ty, které v jednotlivých testech fungovaly nejlépe, se v literatuře vůbec neobjevily.
Jiní autoři uvedli srovnatelné zkušenosti. Cecilia Williamsová, výzkumnice v oblasti rakoviny na KTH Royal Institute of Technology ve Stockholmu, testovala 13 protilátek, aby se pokusila rozplést protichůdné údaje o estrogenovém receptoru β, proteinu objeveném v roce 1996, který je potenciálním cílem léčby proti rakovině. Spolu se svým týmem zjistila, že 12 z těchto protilátek, včetně dvou nejpopulárnějších, poskytlo buď falešně pozitivní, nebo falešně negativní výsledky, nebo obojí. ‚Neberte údaje z literatury ani protilátky jako samozřejmost,‘ varuje.
Vědci často nakupují protilátky podle toho, kolikrát byl produkt citován v literatuře, ale tato strategie může přehlížet novější produkty, které byly podrobeny přísnějším testům. Mají také tendenci předpokládat, že ostatní, kteří protilátku použili před nimi, si ověřili, že funguje tak, jak má, a že tedy bude fungovat i v jejich vlastních experimentech, což otevírá prostor pro opakovaný vznik artefaktů.
‚Když se dívám na vědecké práce obecně, mám z kvality charakterizace protilátek deprese,‘ říká Simon Goodman, vědecký konzultant neziskové profesní asociace Antibody Society. Goodman působí v německém Darmstadtu a pro tuto společnost uspořádal řadu vzdělávacích webinářů o vhodných technikách. Když se zeptáte ‚Jak jste ověřili protilátku?‘ vědci řeknou: ‚No, koupili jsme ji a výrobce tvrdí, že se chová takhle.‘
Údaje, které společnosti poskytují, aby prokázaly, že protilátka funguje, často pocházejí z buněčné linie, která byla upravena tak, aby exprimovala protein v podstatně vyšších hladinách než za fyziologických podmínek.“
„Edwards připouští, že ne každá protilátka může být testována pomocí knockout kontrol. Asi 10% genů je pro život nezbytných, takže knockout buněčná linie pro ně není životaschopná. Také protilátka, která funguje dobře v jedné buněčné linii, může v jiné selhat.“
„Podle Jamese Trimmera, který řídí laboratoř NeuroMab na Kalifornské univerzitě v Davisu, snažící se vyrábět vysoce kvalitní protilátky pro neurovědy, to znamená, že k získání informativních experimentů je zapotřebí více než jen správná protilátka. Protilátka, která spolehlivě funguje, když je protein ve sbaleném (‚nativním‘) stavu uvnitř buňky, může fungovat jinak, když jsou proteiny chemicky změněné v konzervované tkáni nebo rozbalené v buněčných směsích, a i malé změny v přípravě vzorku mohou mít velký dopad.“
Krize identity
„Někdy ani není jasné, jakou protilátku vědci použili, zejména ve starších studiích. Podle analýzy vedené vědci z Kalifornské univerzity v San Diegu (UCSD) a platformy pro sdílení dat SciCrunch v kalifornské La Jolle je možné identifikovat pouze asi 11% protilátek použitých v pracích publikovaných v roce 1997. V současné době se toto číslo zvýšilo na 43%.“
„Sečteno a podtrženo: ať už vyjde experiment s protilátkami jakkoli, vědci by měli být skeptičtí. Když pokusy selžou, vědci často zpochybňují svou vlastní techniku, říká Goodman. Jako mladý vědec si to samozřejmě dáváte za vinu. Podle Edwardse by však vědecká komunita měla být stejně skeptická i k protilátkám, které se zdají být funkční, a požadovat důkazy, že fungují, než se na ně spolehne. Vědci nakupují protilátky, netestují je a pak publikují články, které směrují obor špatným směrem.“
https://www.nature.com/articles/d41586-020-02549-1
Tento poslední článek z března 2021 uvádí tři hlavní důvody této krize reprodukovatelnosti protilátek: variabilita mezi jednotlivými šaržemi, křehké a nestabilní hybridomy a nedostatek standardizované validace. Poukazuje se na to, že alarmující počet vědců přichází s tvrzeními o nereprodukovatelnosti svých experimentů s protilátkami a pojednává o neregulovaném stavu tohoto odvětví:
Nepřesnost, nespecificita a nereprodukovatelnost protilátek jsou příčinou zániku výzkumu
„Protilátky jsou nedílnou součástí výzkumu v oblasti přírodních věd a objevů a vývoje v léčbě a diagnostice. Jsou však ze své podstaty náchylné k variabilitě. Dokonce i když jsou exprimovány jako monoklonální protilátky, systémy buněčných kultur mohou obsahovat chyby, které produkují odlišnou protilátku, což vede k variabilitě mezi jednotlivými šaržemi a k nereprodukovatelnosti experimentu. Termín krize reprodukovatelnosti vznikl počátkem roku 2010 a označuje nedostatek konzistence pozorovaný u výsledků výzkumu, zejména pokud jde o imunoreagencie. K řešení této krize navrhli vědci robustní protokoly a číselné identifikátory pro katalogizaci a sledování protilátek prostřednictvím publikací, aby byla zajištěna reprodukovatelnost. Tyto identifikátory však nezahrnují proteinovou sekvenci jako důležitou vlastnost, která vyžaduje certifikaci. V tomto přehledu se zabýváme tím, proč tento nedostatek v ověřování sekvence proteinu podstatně přispívá k nereprodukovatelnosti protilátek.“
„Jedno z nejčastěji používaných a nejdůležitějších činidel, které se vyskytuje ve většině laboratoří biomedicínského výzkumu, je ústředním prvkem toho, co je známo jako ‚krize reprodukovatelnosti‘. Alarmující počet výzkumných pracovníků v oblasti přírodních věd zaznamenal nereprodukovatelnost svých experimentů s protilátkami, k čemuž přispěly poznatky, které původně objevili A. Bradbury a C. Glenn Begley. Svou snahou upozornit na neregulovaný stav průmyslu s protilátkami pomohli Bradbury a Begley prosadit potřebu reformy tohoto odvětví, včetně potřeby důslednějšího testování a validace.
Základem nereprodukovatelnosti protilátek je problém variability šarží. K tomu dochází, když jsou protilátky prodávány pod stejným katalogovým číslem a stejným dodavatelem, avšak vykazují odlišnou specificitu a/nebo afinitu. To je často důsledkem prostředí buněčné kultivace a/nebo různých zvířat, která je produkují. Vědci musí překonat nejen problémy spojené s komerční výrobou protilátek, ale pokud se rozhodnou vyrábět vlastní protilátky, mohou se potýkat s mnoha dalšími překážkami. Zejména udržení vysoce standardních procedurálních kontrol pro udržení životaschopnosti buněčných linií.
Výzvy spojené s výrobou a dodávkami protilátek představují pro výzkumné pracovníky značný problém, přičemž nejhorší scénáře brání reprodukovatelnosti experimentů.“
1. VARIABILITA MEZI JEDNOTLIVÝMI ŠARŽEMI – VEDLEJŠÍ DŮSLEDEK VÝVOJE POLYKLONÁLNÍCH PROTILÁTEK
„Ke krizi reprodukovatelnosti protilátek přispívají různé faktory. První vychází z povahy výroby protilátek. Protilátky jsou v lidském a zvířecím těle produkovány B-lymfocyty v polyklonální směsi heterogenních molekul, které rozpoznávají a vážou se na různé epitopy antigenu. V laboratoři se polyklonální protilátky vyrábějí injekčním podáním určitého antigenu zvířeti, což vyvolá imunitní odpověď. Vytvořené polyklonální protilátky se pak ze zvířete odeberou a použijí se v různých experimentech specifických pro antigen.
Krize reprodukovatelnosti při vývoji na bázi polyklonálních protilátek pramení z variability mezi jednotlivými šaržemi, ke které běžně dochází během výroby. Problém nastává, když jsou různým hostitelským zvířatům aplikovány stejné antigeny, ale pak produkují polyklonální protilátky, které mají různou specificitu a afinitu. To znamená, že i kdyby se použila nová šarže protilátek, nelze reprodukovat přesně stejné výsledky experimentu. Ještě důležitější je, že stejné zvíře může mít někdy různé imunitní reakce na stejný antigen a také vykazuje odchylky závislé na čase, známé jako proces afinitní maturace.
2. KŘEHKÉ, NESTABILNÍ HYBRIDOMY OHROŽUJÍ MONOKLONÁLNÍ PROTILÁTKY
Od převratného objevu technologie hybridomů Köhlerem a Milsteinem v roce 1975 zůstává tato technologie pro vědce hlavní metodou produkce monoklonálních protilátek. Proces začíná injekčním podáním specifického antigenu zvířatům, který vyvolá imunitní reakci. Jednotlivé B-lymfocyty produkující protilátky, které se vážou na injikovaný antigen, jsou poté izolovány ze zvířete a sloučeny s buňkami myelomu za účelem vytvoření hybridní buněčné linie zvané hybridom. Díky spojení B-lymfocytů s krátkou životností produkujících protilátky s nesmrtelnými buňkami myelomu se očekává, že hybridomové buňky poskytnou nekonečnou zásobu identických monoklonálních protilátek.
V laboratoři jsou však hybridomy často považovány za nestabilní a křehké, takže vyžadují vysoce standardní procedurální kontroly, aby byla udržena životaschopnost buněčné linie. Přestože výzkumníci věnují kultivaci hybridomových buněčných linií značné množství času a úsilí, stále pravidelně dochází ke špatnému růstu, nebo dokonce k odumírání buněk. Za normálních podmínek může obsah protilátek v průběhu kultivace hybridomu průběžně klesat. K selhání přežití hybridomů může vést mnoho dalších faktorů. Dlouhodobé skladování, opakované cykly zmrazování a rozmrazování, nesprávná manipulace a kontaminace mohou způsobit odumření hybridomů a trvalou ztrátu důležitých protilátek.
Kromě toho je také známo, že hybridomové buněčné linie v průběhu času podléhají genovým mutacím a přestavbám, což vede k heterogenitě protilátek a variabilitě mezi jednotlivými šaržemi. Nedávná studie 185 klonálních hybridomových buněčných linií zjistila, že téměř třetina z nich obsahovala další geny pro těžké nebo lehké řetězce, což mělo za následek zhoršenou afinitu a specificitu k cílovému antigenu. Šetření provedené společností Rapid Novor v roce 2019 ukázalo podobné výsledky – mezi 80 analyzovanými monoklonálními protilátkami pro výzkumné účely se ukázalo, že významná část (14%) měla přítomný druhý lehký řetězec. V jiných případech mohou hybridomy dokonce ztratit chromozom obsahující geny pro protilátky, čímž se tvorba protilátek zcela zastaví.
3. NEDOSTATEK STANDARDIZOVANÉ VALIDACE – KDYŽ PROTILÁTKY KLAMOU
Navzdory složitosti a nejistotě výroby protilátek neexistuje žádný standardizovaný protokol nebo předpis pro validaci protilátek, včetně hodnocení jejich specificity, afinity, sekvencí a použití v různých testech.
Mezi více než 2 miliony komerčních protilátek poskytovaných více než 300 dodavateli je většina z nich polyklonálních. Údaje o kontrole kvality uvedené na produktových listech jsou často získány z předchozích šarží a pro ty, které jsou dodávány uživatelům, již neplatí. Pokud jde o monoklonální protilátky, nelze také zjistit, zda je současná hybridomová buněčná linie charakterizována jako stabilní a funkční. To do značné míry vyplývá z problému nekonzistentních katalogových čísel, která nezohlednila nová kultivační prostředí, produkční zvířata nebo fúze společností. Nedostatek řádné validace vede k uvolňování velkého množství špatně charakterizovaných protilátek (‚špatných protilátek‘) uživatelům pro výzkum. Odhaduje se, že přestože jsou na trhu 2 miliony protilátek, pouze 12,5 – 25% je považováno za jedinečné ‚hlavní‘ protilátky.
Pokud jde o výběr klíčových protilátek, postup se liší podle uživatele a laboratoře. Některé laboratoře například pravidelně nakupují od svých důvěryhodných dodavatelů, některé se spoléhají na ústní informace a některé nakupují několik protilátek od různých dodavatelů a pak testují, která z nich funguje. Často dochází k tomu, že vědci odkazují na publikace, v nichž byly jejich protilátky uvedeny, nebo se odvolávají na informace uvedené v produktových listech. To však ještě nezaručuje naprosto bezpečné rozhodnutí. Vezměme si například protilátky, které byly použity k identifikaci terapeuticky relevantních klinických biomarkerů. Navzdory tomu, že všechny tyto protilátky byly pravidelně citovány v oborových publikacích a časopisech pro jejich příslušné případy použití, u všech byla prokázána zkřížená reaktivita, což vedlo ke ztrátě značných částek prostředků na výzkum.
Použití protilátek jako nástrojů pro detekci biomarkerů tak může být potenciálně fatální, pokud nebyly plně ověřeny přísnou kontrolou. Skutečnost je bohužel taková, že již nestačí spoléhat se pouze na protokoly dodavatele o zajištění kvality nebo na vědecké publikace, ale je nutné kandidáty nezávisle posoudit a ověřit.“
Antibody Inaccuracy, Non-specificity, Irreproducibility – Research Extinction (rapidnovor.com)

Kdo mohl předvídat, že se budou plýtvat peníze a prostředky na studium teoretických částic,
jejichž existence nebyla nikdy prokázána?
SHRNUTÍ:
- Protilátky jsou hybnou silou biologických experimentů, avšak tuto oblast zamořují chybnými nálezy.
- Řada vědců přišla s tvrzením, že nejsou schopni reprodukovat své vlastní výsledky při použití stejných protilátek.
- Variabilita mezi jednotlivými šaržemi vedla k tomu, že konzistentně vznikaly různé výsledky a protilátky se vázaly na proteiny, na které se vázat neměly.
- Vědci, kteří na špatné zkušenosti s protilátkami doplatili, volají po vytvoření standardů, podle kterých by se měly protilátky vyrábět, používat a popisovat.
- Mnozí se domnívají, že protilátky jsou hlavní příčinou krize reprodukovatelnosti.
- Při analýze 49 komerčně dostupných protilátek, které se zaměřovaly na 19 signálních receptorů, se většina z nich vázala na více než jeden protein, což znamená, že se jim nedá důvěřovat v tom, že by rozlišovaly jednotlivé receptory.
- V roce 2011 bylo při hodnocení 246 protilátek používaných v epigenetických studiích zjištěno, že jedna čtvrtina z nich selhala v testech specificity, což znamená, že se často vázaly na více než jeden cíl a čtyři protilátky byly dokonale specifické – ale na nesprávný cíl.
- V rámci projektu Human Protein Atlas bylo dosud prozkoumáno 20 000 komerčních protilátek a bylo zjištěno, že ke zkoumání distribuce proteinů v konzervovaných řezech tkáně lze efektivně použít méně než 50% z nich.
- To vedlo některé vědce k tvrzení, že až polovina všech komerčně dostupných protilátek je nespolehlivá.
- Spolehlivost protilátek závisí na experimentu – v některých případech jsou „obvykle v pořádku“ a v jiných jsou hrozné.
- Nedostatečná charakterizace protilátek vedla k mnoha chybným/nereprodukovatelným výsledkům.
- Byla zjištěna nedostatečná specificita protilátek, kdy se vážou na více než jeden protein nebo se nevážou na ten, na který se mají vázat.
- Informace prodejců protilátek se značně liší, protože:
- Neposkytují údaje potřebné k vyhodnocení specificity dané protilátky nebo její variability mezi jednotlivými šaržemi.
- Mohou dodávat šarže protilátek s charakterizačními informacemi odvozenými z předchozí šarže.
- Jejich údaje jsou často získávány za ideálních podmínek, které neodrážejí typické experimenty.
- Tvrdí, že není možné testovat jejich produkty za všech experimentálních podmínek.
- Prodejci neposkytují validované údaje o svých protilátkových produktech.
- Společnosti se více zabývají optimalizací výsledků vyhledávání než optimalizací svých činidel.
- Prodejci se také více zajímají o ochranu obchodního tajemství než o zajišťování validace.
- Tlak na charakterizaci v současnosti dostupných protilátek prudce roste, protože:
- Ve snaze zlepšit reprodukovatelnost začali někteří výzkumní pracovníci diskutovat o zapojení nezávislého orgánu do vytvoření certifikačního programu pro komerční protilátky.
- Některé časopisy (včetně Nature) požadují po autorech, aby jasně uváděli, že protilátky použité v jejich pracích byly profilovány pro danou aplikaci.
- Současný názor je, že výrobci by měli být odpovědní za řešení problémů variability mezi jednotlivými šaržemi, specificity a charakterizace.
- Průzkum mezi výrobci protilátek ukázal, že když byli požádáni o návrhy, jak zlepšit standardy kvality, 37% z nich navrhlo zavedení globálních standardů.
- Článek Bradburyho, Pluckthuna a 110 spolusignatářů ve vědeckém časopise Nature popsal nejednotnou úroveň charakterizace mezi výrobci a potenciální problémy spojené s hybridomy.
- Krátká poznámka k hybridomům:
- Jedná se o hybridní buňky používané jako základ pro výrobu protilátek ve velkém množství pro diagnostické nebo terapeutické použití. Hybridomy se vyrábějí tak, že se myši injekčně aplikuje specifický antigen, ze sleziny myši se poté odeberou buňky produkující protilátky a sloučí se s nádorovými buňkami zvanými myelomové buňky. Hybridomové buňky se v laboratoři množí neomezeně dlouho a mohou být použity k produkci specifických protilátek po neomezenou dobu.
- Stále více se projevuje snaha o upuštění od polyklonálních a monoklonálních protilátek ve prospěch rekombinantních protilátek s cílem tuto krizi vyřešit.
- Další krátká poznámka na okraj: rekombinantní protilátky jsou většinou syntetické:
- „Rekombinantní protilátky jsou v podstatě monoklonální protilátky vytvořené in vitro pomocí syntetických genů. Technologie zahrnuje získání genů pro protilátky ze zdrojových buněk, amplifikaci a klonování genů do vhodného fágového vektoru, zavedení vektoru do hostitele (bakterie, kvasinky nebo savčí buněčné linie) a dosažení exprese odpovídajícího množství funkční protilátky.“ (https://www.google.com/amp/s/info.gbiosciences.com/blog/recombinant-antibodies-an-overview%3fhs_amp=true)
- Na 3. mezinárodním setkání pro validaci protilátek, které se konalo v Bathu, byl rovněž zdůrazněn význam antigenů při tvorbě, charakterizaci a validaci protilátek.
- Řečníci zdůraznili, že pro efektivní tvorbu protilátek je nutné, aby se jednalo o proteiny plné délky, správně složené a „autentické“.
- Byl kladen důraz na správné použití, protože výkonnost protilátek závisí na jejich aplikaci.
- Protilátky vyrobené pro vazbu na jeden protein se často mohou vázat na jiný protein a někdy s lepší afinitou.
- Cecilia Williamsová, výzkumnice v oblasti rakoviny na KTH Royal Institute of Technology ve Stockholmu, testovala 13 protilátek a 12 z nich, včetně dvou nejoblíbenějších, poskytlo buď falešně pozitivní, nebo falešně negativní výsledky, nebo OBOJÍ.
- Vědci často používají protilátky, které v literatuře citují jiní vědci, a PŘEDPOKLÁDAJÍ, že jsou zkontrolované/ověřené, což vede k opakovanému vzniku artefaktů.
- Údaje, které společnosti poskytují, aby prokázaly, že protilátka funguje, pocházejí z buněčné linie, která byla upravena tak, aby exprimovala protein v hladinách podstatně vyšších než za fyziologických podmínek.
- Protilátka, která dobře funguje v jedné buněčné linii, může v jiné linii selhat.
- Protilátka, která spolehlivě funguje, když je protein v buňce ve sbaleném („nativním“) stavu, může fungovat jinak, když jsou proteiny chemicky změněné v konzervované tkáni nebo rozbalené v buněčných směsích, a i malé změny v přípravě vzorku mohou mít velký dopad.
- Někdy není ani jasné, jakou protilátku vědci použili, zejména ve starších studiích.
- Podle analýzy vedené vědci z Kalifornské univerzity v San Diegu (UCSD) je možné identifikovat pouze asi 11% protilátek použitých v pracích publikovaných v roce 1997.
- Mnozí varují, že by vědci měli být k výzkumu protilátek skeptičtí, a to i k protilátkám, které se zdají být funkční.
- Protilátky jsou ze své podstaty náchylné k variabilitě.
- Dokonce i když jsou exprimovány jako monoklonální protilátky, systémy buněčných kultur mohou obsahovat chyby, které produkují odlišnou protilátku, což vede k variabilitě mezi jednotlivými šaržemi a k nereprodukovatelnosti experimentu.
- Nedostatečné ověřování sekvencí proteinů podstatně přispívá k nereprodukovatelnosti protilátek.
- Alarmující počet výzkumných pracovníků v oblasti přírodních věd zaznamenal nereprodukovatelnost svých experimentů s protilátkami.
- Odvětví výroby protilátek není regulováno.
- Základem nereprodukovatelnosti protilátek je problém variability šarží.
- To se týká protilátek prodávaných pod stejným katalogovým číslem a stejným dodavatelem, které však vykazují rozdílnou specificitu a/nebo afinitu.
- Často je to důsledek prostředí buněčné kultivace a/nebo různých zvířat, která je produkují.
- 3 hlavní problémy, které přispívají ke krizi reprodukovatelnosti:
- Variabilita mezi jednotlivými šaržemi
- Krize reprodukovatelnosti při vývoji na bázi polyklonálních protilátek pramení z variability mezi jednotlivými šaržemi, ke které běžně dochází během výroby.
- Problém vzniká, když je různým hostitelským zvířatům aplikován stejný antigen, ale pak produkují polyklonální protilátky, které mají různou specificitu a afinitu.
- To znamená, že i kdyby se použila nová šarže protilátek, nelze reprodukovat přesně stejné výsledky experimentu.
- Křehké, nestabilní hybridomy
- Hybridomy jsou často považovány za nestabilní a křehké, takže vyžadují vysoce standardní procedurální kontroly, aby byla udržena životaschopnost buněčných linií.
- Pravidelně dochází ke špatnému růstu, nebo dokonce k odumírání buněk.
- Dlouhodobé skladování, opakované cykly zmrazování a rozmrazování, nesprávná manipulace a kontaminace mohou způsobit odumření hybridomů a trvalou ztrátu důležitých protilátek.
- Je také známo, že hybridomové buněčné linie v průběhu času podléhají genovým mutacím a přestavbám, což vede k heterogenitě protilátek a variabilitě mezi jednotlivými šaržemi.
- Nedávná studie 185 klonálních hybridomových buněčných linií zjistila, že téměř třetina z nich obsahovala další geny pro těžké nebo lehké řetězce, což mělo za následek zhoršenou afinitu a specificitu k cílovému antigenu.
- Hybridomy mohou dokonce ztratit chromozom obsahující geny pro protilátky, čímž se zcela zastaví tvorba protilátek.
- Nedostatek standardizované validace
- Neexistuje žádný standardizovaný protokol nebo předpis pro validaci protilátek, včetně hodnocení jejich specificity, afinity, sekvencí a použití v různých testech.
- Údaje o kontrole kvality uvedené na produktových listech jsou často získány z předchozích šarží a pro ty, které jsou dodávány uživatelům, již neplatí.
- Pokud jde o monoklonální protilátky, nelze také zjistit, zda je současná hybridomová buněčná linie charakterizována jako stabilní a funkční.
- Nedostatek řádné validace vede k uvolňování velkého množství špatně charakterizovaných protilátek („špatných protilátek“) uživatelům pro výzkum.
- U všech protilátek, které byly použity k identifikaci terapeuticky relevantních klinických biomarkerů a byly pravidelně citovány v oborových publikacích a časopisech pro jejich příslušné případy použití, se ukázalo, že vykazují zkříženou reaktivitu, což vedlo ke ztrátě značných částek prostředků na výzkum.
- Již nestačí spoléhat se pouze na protokoly dodavatele o zajištění kvality nebo vědecké publikace.
- Variabilita mezi jednotlivými šaržemi
Vzhledem k nedostatku důkazů o purifikovaných/izolovaných protilátkách za poslední století a alarmující krizi reprodukovatelnosti by nyní mělo být jasné, proč výzkumníci/vědci/doktoři atd. nemají ponětí, jak odpovědět na otázky týkající se protilátek. Nedokážou říct, kolik protilátek je potřeba k ochraně. Nedokážou říct, zda poskytují celoživotní imunitu nebo vůbec nějakou imunitu. Nedokážou vysvětlit, jak mohou být protilátky známkou ochrany v případě vakcín, ale zároveň známkou nemoci v případě HIV. Nedokážou přesně interpretovat výsledky testů, vysvětlit, co znamenají, ani uvést důvody vysokého počtu falešně pozitivních výsledků. O těchto hypotetických/teoretických částicích prostě nic nevědí, protože „věda“, která za nimi stojí, je přinejlepším sporná a zcela nereprodukovatelná/neopakovatelná.
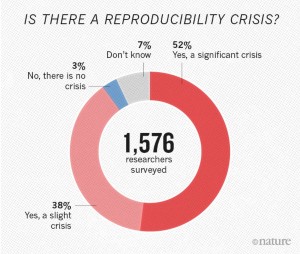
Správná odpověď je zřejmá:
„ANO, VÁŽNÁ KRIZE.“







